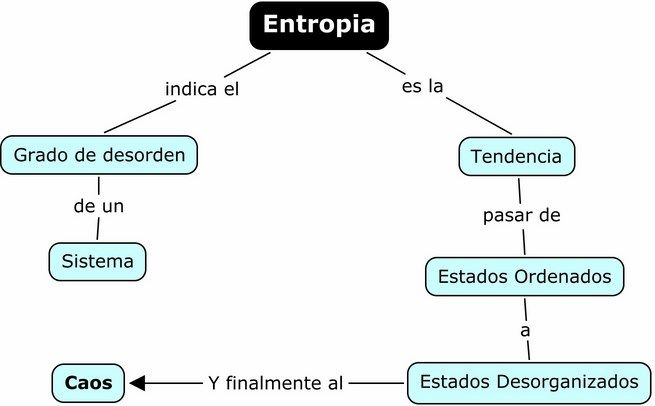
La palabra entropía procede del griego (θτρωπη) y significa evolución o transformación, es una medida del desorden.
– Mayor entropía significa mayor desorden.
– Menor entropía significa más orden.
El término entropía se puede utilizar en Física, Química, Psicología, de forma filosófica, en las Empresas, etc.
Lógicamente la entropía que nosotros estudiaremos es aquella relacionada con la física y la química.
Nota: lo contrario a la entropía es la entropía negativa o neguentropía.
Indice de Contenidos
Entropía Significado
La entropía es una «propiedad de estado» en la que importa solamente el estado inicial y final, independientemente del camino recorrido para pasar de uno a otro.
La entropía no se define en valores absolutos, se miden cambios (incrementos = Δ) entre uno y otro estado entrópico.
Pongamos algún ejemplo para que te queda mucho más claro.
Primero un sistema reversible y luego un sistema irreversible (sistema que no puede volver al estado inicial).
Ejemplos de Entropía
Tenemos una habitación ordenada = Sistema Inicial. Ahora la desordenamos, tiramos la ropa, muebles, etc.
Hemos cambiado el sistema inicial y ahora tengo un sistema final = habitación desordenada.
Si quieres colocar las cosas para que esté la habitación ordenada te costará más o menos trabajo, en función de lo desordenada que acabara la habitación.
Más desordenada implica que necesito más trabajo para volver a ordenarla (volver al estado inicial).
La habitación al principio tenía muy poco entropía, ya que estaba bastante ordenada, pero después del proceso (desordenarla) aumentó la entropía.
Cuanto más he variado el sistema inicial (habitación ordenada), más trabajo me costará volver al estado inicial, más entropía tengo en mi habitación o más desorden.
No solo es más difícil volver al estado inicial cuanto más lo cambio, sino que además tendremos menos posibilidades de volver el sistema (habitación) al estado inicial.
Incluso pudiera ser que nunca lograra volver al estado inicial, la habitación igual de ordenada que al principio, esto ocurre en los sistemas llamados «Irreversibles».
Los estados irreversibles aumentan la entropía.
Los estados que hemos cambiado mucho, tienen mucha entropía.
Variación pequeña del estado inicial = poco entropía tenemos en el estado final.
Variación muy grande del estado inicial = gran entropía tenemos en el estado final.
Si un sistema experimenta un gran aumento de la entropía en el proceso de cambio, el sistema se vuelve irreversible.
Un ejemplo de Sistema Irreversible.
Rompemos un plato, el plato roto tendrá una gran entropía por que es irreversible, ya no podremos dejarlo como estaba al principio.
Del plato nuevo al roto se experimenta un gran aumento de la entropía.
Freír un huevo es otro proceso irreversible.
Hay una ley fundamental de la Naturaleza que dice que en todo proceso natural la entropía crece.
Por lo tanto, la entropía, se trata de una cantidad que no decrece en ningún proceso físico, y que por lo general crece, dando lugar a procesos que reciben el nombre de irreversibles, porque no se pueden deshacer, no es posible volver al estado de entropía anterior, dado que ésta no puede decrecer.
Veamos un ejemplo más físico y real de un sistema irreversible.
Si echamos una gota de tinta en agua observamos cómo ésta se difunde hasta que toda el agua se vuelve de color uniforme.
Lo que jamás veremos es que las partículas de tinta se reúnan de nuevo en una gota separada del agua.
Al cambiar el sistema inicial echando la gota de tinta, hemos aumentado tanto la entropía del sistema, que se vuelve irreversible.
Entonces….
¿Cómo Medimos la entropía?
La manera de utilizarla es medirla en nuestro sistema inicial, es decir, antes de cambiar el sistema, y volverla a medir al final del proceso que sufrió el sistema.
Es importante señalar que la entropía no está definida como una cantidad absoluta S (símbolo de la entropía), sino lo que se puede medir es la diferencia entre la entropía inicial de un sistema Si y la entropía final del mismo Sf.
Es por eso que la fórmula de la entropía sería:
ΔS= incremento de entropía = Sf – Si.
No tiene sentido hablar de entropía sino en términos de un cambio en las condiciones de un sistema.
La Entropía en la Química y La Física
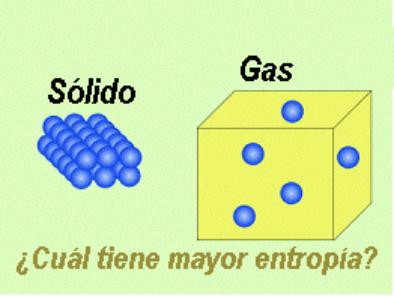
Si hablamos de la entropía en química, podríamos decir que es el desorden que tienen las moléculas en un sistema.
Un ejemplo:
¿Qué Estado Tiene más Entropía?
Pues lógicamente el gas, por que tiene sus moléculas más desordenadas.
Además si calentamos el gas, sabemos que las moléculas adquieren mayor velocidad, están más desordenadas, o lo que es lo mismo al aumentar la temperatura aumentamos la entropía.
Otro ejemplo: Imagina un bote de perfume y pulverizamos sobre una esquina de una habitación.
El perfume no sólo permanecerá en ese rincón de la habitación.
Las moléculas de perfume acabarán llenando la habitación.
El perfume pasó de un estado ordenado a un estado de desorden, extendiéndose por toda la habitación y aumentando su entropía.
Bueno ahora llevemos el término de entropía a la física, mejor a la parte de la física llamada termodinámica, que es la que se ocupa del estudio de las relaciones que se establecen entre el calor y el resto de las formas de energía.
En termodinámica, podemos definir la entropía como la «energía no aprovechable» para realizar un trabajo.
Es decir, una energía que está ahí, pero que no podemos utilizar.
¿Y eso por qué?.
No podemos transformar el 100% del calor en energía aprovechable.
El primer principio de la termodinámica dice que la energía ni se crea ni se destruye entonces…
Si yo pongo en contacto un líquido caliente con uno frío, el calor pasa al liquido frío calentándolo y el caliente se enfría.
Si ahora quiero volver el sistema del líquido inicial caliente, desde el sistema frio, no se puede hacer de forma espontánea, necesitamos una fuente de energía externa, pero además la energía necesaria para volver el liquido caliente a su estado inicial es mayor que la que energía que cedió al frío.
¿Qué ha pasado?
Pues que hay una pérdida de energía que necesitamos aportar para volver al estado inicial, esta perdida de energía, o energía que necesitamos para volver al estado inicial es la entropía.
La 2ª ley establece la imposibilidad de convertir completamente toda la energía de un tipo en otro sin pérdidas.
En todo proceso, perderemos algo de energía, en forma de calor, que se utilizará para elevar la temperatura de algún componente de la máquina, o de su entorno, y no podremos aprovechar.
La naturaleza establece que el total de energía asociada con una fuente térmica nunca puede ser transformada íntegra y completamente en trabajo útil.
De aquí que todo el trabajo se puede convertir en calor pero no todo el calor puede convertirse en trabajo.
De esta forma, la segunda ley impone restricciones para las transferencias de energía que hipotéticamente pudieran llevarse a cabo teniendo en cuenta sólo el Primer Principio.
Si aceptamos que se cumple la 1ª ley, quiere decir que si toda la energía no se ha convertido tenemos que aceptar la existencia de una magnitud física llamada entropía, aquella energía que no se ha convertido totalmente en trabajo útil.
El físico Rudolf Clausius, a raíz del trabajo pionero del ingeniero militar francés Sadi Carnot sobre la máxima eficiencia de los motores térmicos, el fue el primero en determinar la «entropía» y dar una definición cuantitativa (de cantidad).
Fue capaz de poner una fórmula para la entropía.
Según Clausius, el cambio de entropía ΔS de un sistema termodinámico que absorbe una cantidad de calor ΔQ a una temperatura absoluta T es simplemente la relación entre los dos:
ΔS = ΔQ / T
Enunciado de Kelvin
No existe ningún dispositivo que, operando por ciclos, absorba calor de una única fuente (E.absorbida), y lo convierta íntegramente en trabajo (E.útil).
Si te das cuenta en termodinámica la entropía y el calor están muy relacionados, por eso la entropía tiene la siguiente unidad, que definimos:
– La unidad de la entropía es un joule por kelvin (J/K).
¿Qué es?.
Es el aumento de entropía de un sistema que recibe una cantidad de calor de 1 joule, a la temperatura termodinámica constante de 1 kelvin, siempre que en el sistema no tenga lugar ninguna transformación irreversible.
Para dejar un poco más claro de cara a la física y la química, la entropía os dejamos este video:
Un Poco de Historia de la Entropía
El concepto de entropía aparece con Rudolf Clausius como parte del razonamiento con el que se enfrenta al problema de encontrar una expresión matemática para describir todas las transformaciones de un cuerpo ante un intercambio de calor entre ese cuerpo y otro o con el exterior.
Trata de esclarecer las relaciones de calor y energía en lo que el mismo denomina “principio de equivalencia de las transformaciones de energía” y al cual le asigna, al menos, dos significados; “el trabajo puede transformarse en calor y recíprocamente”, y “el calor no puede pasar de sí mismo de un cuerpo frío a uno caliente”.
Clausius encuentra que el calor cedido por un cuerpo, es equivalente a la variación de calor que contenga el cuerpo, más el trabajo que realice el cuerpo durante la modificación en el arreglo de las partículas del cuerpo.
El nombre de entropía fue designado por Clausius para dar sentido a un proceso que ocurre con la energía, como él describe
“…propongo llamar a la cantidad S la entropía del cuerpo tomando la palabra griega transformación (θτρωπη).
El diseño que yo he armado con la palabra entropía lo hice de manera que se asemejara tanto como fuera posible a la palabra energía”.
Si te ha gustado la web sobre Entropía pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.

Es increíble cuanto estoy aprendiendo,ustedes merecen respeto y admiración. A mis 69 ya cumplidos me han echo enamorarme de la termodinámica. Ojalá Dios me de vida para no perderme ninguno de sus artículos HectorAngel
Muchas gracias por tu comentario. Me alegra mucho que te sirva de ayuda la web. Un saludo
Podrian explicar en terminos sencillos el DEMONIO DE MAXWELL
Los demonios maxwellianos son dispositivos mecánicos que realizan mediciones en un sistema termodinámico, manipulan el sistema para extraer trabajo de él y borran todos los registros de los resultados de la medición. Si tienen éxito, disminuyen la entropía total del universo, violando así la Segunda Ley de la Termodinámica.
Interesantes, conservan mis neuronas.
Pueden aplicar la entropía a la cosmología? Seria interesante.
Claro que se puede. Quizás te interese este enlace; Origen del Universo
es interesante pero algo ingenuo y hay quienes sin entender Física hacen preguntas disparatadas —
El ejemplo utilizado: «Si yo pongo en contacto un líquido caliente con uno frío, el calor pasa al liquido frío calentándolo y el caliente se enfría.» no es correcto tal como se enuncia.
Un liquido no está mas caliente que otro, en realidad un liquido tiene mas temperatura que el otro y el calor fluye de un liquido de mas temperatura a otro de menor temperatura hasta logra el equilibrio térmico.
excelente pagina, muy facil de entender, les agradezco mucho!!!
Muy interesante; por fin lo he entendido. Moltes gràcies.
como explica en el campo biologico la energia neguentropica