Indice de Contenidos
Gas Ideal
El gas ideal es aquel en que sus moléculas o átomos no se atraen entre sí (sin interacción entre ellos, no existe fuerza de atracción intermolecular), por lo que su comportamiento se puede explicar de una forma fija, cumpliendo 3 relaciones o leyes:
Ley de los gases ideales, la ley de charles Gay-Lussac y la Ley de Boyle.
Leyes que luego estudiaremos.
Un Gas Ideal podríamos visualizarlo como una colección de esferas (átomos o moléculas) duras que chocan unas con otras, siendo esa fuerza de choque la única que existe entre ellas.
En los gases ideales la presión ejercida por el gas se debe a los choques de las moléculas con las paredes del recipiente durante su movimiento.
Los gases ideales en realidad no existen, solo son ciertos gases se pueden considerar que tienen un comportamiento de un gas ideal bajo ciertas condiciones.
Los que se encuentran al lado derecho de la tabla periódica, que se llaman gases nobles, se comportan como gases ideales cuando se encuentran en condiciones normales de presión y temperatura (presión de 1 atmósfera y a una temperatura de 273,15 kelvin, o lo que es lo mismo a – 0ºC.)
Ejemplos de gases que se suelen considerar como gas ideal en condiciones normales de presión y temperatura son: el helio, el hidrógeno, el argón, el nitrógeno, el dióxido de carbono, etc. Aquí tienes un lista mayor:
La mayoría de los gases reales, presenta un comportamiento aproximadamente ideal solo cuando están a presiones bajas y temperaturas altas, condiciones en las existe un gran espacio “libre” para el movimiento de las moléculas y por lo tanto, es pequeña la fuerza de atracción intermolecular.
Cualquier gas real puede comportarse como ideal dependiendo de las condiciones en que se encuentre.
En condiciones normales, tales como condiciones normales de presión y temperatura, la mayoría de los gases reales pueden ser tratados como gases ideales para hacer cálculos con ellos, siempre dentro de una tolerancia razonable de error.
Una vez estudiada las dos leyes que se pueden aplicar a los gases cuando se consideran ideales, puedes ver estos ejercicios resueltos y explicados: Problemas de Gases.
OJO aunque la mayóría de las veces el término gas ideal es igual al de gas perfecto, hay una pequeña diferencia que lo puedes ver en el siguiente enlace: Gas Perfecto.
Ley de los Gases Ideales
La ley general de las Gases Ideales se expresa en la siguiente fórmula:
PV=nRT
Donde:
P: presión en atmósferas (atm) 1atm = 760 mmHg.
V: Volumen en litros 1l = dm3.
n : número de moles. Para saber que es un mol y como se calcula visita este enlace: Mol.
R = 0,082 atm l / K mol (es una constante, siempre la misma).
T : temperatura en Kelvin ( K). Para pasar de Grados Centígrados a Kelvin suma 273. Ejemplo: 25ºC= 25+273=298K.
Pero… si tenemos un mismo gas que cambia de presión, temperatura o volumen (pasa de un estado 1 a otro diferente 2 pero seguirá siendo el mismo gas)
¿Qué pasará….?
Lo primero (P x V) / T = n x R; como las constantes n y R son las mismas en los dos estados (es el mismo gas), el término P x V / T será el mismo en los dos estados también.
Por lo tanto podríamos deducir la siguiente ecuación:
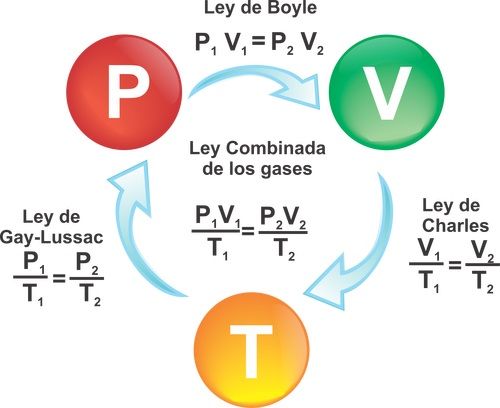
(P1 x V1) / T1 = (P2 x V2) / T2
Siendo el estado 1 el inicial del gas ideal y el estado 2 el final del mismo gas.
De aquí deducimos las 3 leyes que cumplen todos los gases ideales de forma muy sencilla y que veremos una a una a continuación.
Si no te ha quedado claro la ley de los Gases Ideales mira este video antes de continuar.
LAS 3 LEYES QUE CUMPLEN LOS GASES IDEALES
Ley de Charles o De Gay-Lussac
La ecuación de Gay-Lussac demuestra que la presión de una masa gaseosa (gas) a volumen constante, es directamente proporcional a la temperatura. Esta ley se expresa con la fórmula solo cuando el gas tiene un volumen constante (no cambia de volumen).
P1/T1 = P2/T2
P1 = presión inicial
T1= temperatura inicial
P2 = presión final
T2= temperatura final
También se puede expresar de la siguiente forma: el cociente entre el volumen inicial del gas y su temperatura inicial es igual al cociente entre el volumen final del gas y su temperatura final: Vi/Ti=Vf/Tf. ¿Por qué?
Si tenemos en cuenta que P = n x V x T y lo sustituimos en la ecuación anterior:
(n x V1 x T1) /T1 = (n x V2 x T2)/T2; n es constante y se va.
Ley de Boyle
Expresa la relación entre la presión y el volumen de un gas cuando su temperatura es constante.
En este caso la fórmula quedaría:
P1 X V1 = P2 X V2
Ley de Charles
Expresa la relación entre la temperatura y el volumen de un gas cuando su presión es constante.
En este caso la fórmula quedaría así:
V1 / T1 = V2 / T2
Con todo lo explicado ahora es el momento de ir a ver los Problemas de Gases.
¿Te ha gustado la web Ley de Los Gases Ideales?. Pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.


Como puedo citar la informacion, quien lo redacto y en que año?
Mediante la webgrafía, es decir la URL de la página web donde sacaste la información. Un saludo