El gas perfecto es aquel en el que no se consideran las fuerzas intermoleculares, los átomos no tienen fuerza de atracción entre sí, pero además obedece la ley de los gases ideales y tiene calores específicos constantes.
El que deba tener calores específicos constantes es lo que le diferencia del Gas Ideal.
El Gas Ideal no necesita esta característica para ser un gas ideal.
Recuerda: El calor específico (o capacidad calorífica específica) es la energía necesaria para elevar en un 1 grado la temperatura de 1 kg de masa.
Sus unidades en el Sistema Internacional son J/kg.
Podríamos decir que se llama gas perfecto al gas ideal con calores específicos constantes.
Todos los Gases Perfectos son Gases Ideales.
La mayoría de los gases reales se comportan como gases perfectos a bajas presiones y a temperaturas muy altas.
En todo caso, para cualquier gas en intervalos pequeños de temperatura se puede suponer que el calor específico es aproximadamente constante, por lo que se suele utilizar el térmico Gas Perfecto igual al de Gas Ideal.
Si bien ningún gas real tiene las propiedades necesarias para ser un gas ideal o perfecto.
El comportamiento de los gases reales se puede considerar parecido a la de estos gases y cumplen la ley general del gas ideal, con un error muy pequeño siempre que estén a bajas presiones y temperaturas altas, cuando hay distancias relativamente grandes entre las moléculas y cuando sus altas velocidades hacen que no exista interacción entre sus moléculas o átomos.
Pero OJO, un gas real no se puede considerar un gas perfecto o ideal cuando las condiciones son tales que el gas, o cualquiera de los gases componentes de una mezcla, está cerca de su punto de condensación, temperatura a la que se licua.
Como los Gases Perfectos son todos Gases Ideales, quiere decir que podemos trabajar con las ecuaciones de los gases ideales para resolver problemas de los gases perfectos.
Recordamos la ecuación de los gases ideales, válida también para los gases perfectos:
pV = nRT donde;
p = presión en Pascales.
V = volumen en metros cúbicos.
n = número de moles. Ver Mol.
R = constante de los gases. El valor de SI para R es 8.31441 JK -1 mol-1
T = Temperatura en Grados Kelvin (K). Si te la dan en grados centígrados (ºC) no olvides sumarle 273 a los grados centígrados para pasarlos a Kelvin.
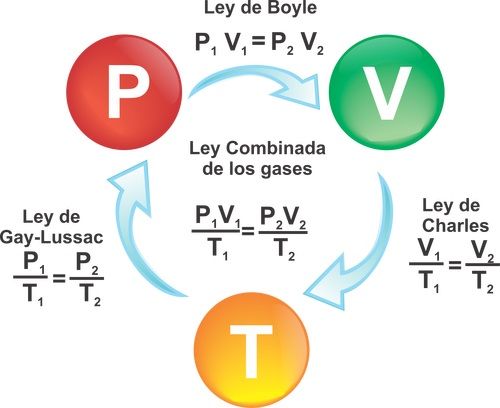
Pero los gases ideales, y los perfectos, cumplen 3 leyes, que podemos utilizar para nuestros cálculos. Aquí las tienes:
Para más información sobre estas leyes visita: Leyes de los Gases Ideales.
Puedes ver problemas resueltos aquí: Problemas de Gases.
¿Te ha gustado la web Gas Perfecto?. Pulsa en Compartir y Gracias por Compartir.
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.