Indice de Contenidos
¿Qué son los Cambios de Estados?
La materia se puede presentar en 3 estados diferentes: solido, líquido y gaseoso.
Hay un cuarto estado, plasma, mucho menos estudiado y que luego veremos un poco acerca de el.
«Cuando la materia pasa de uno de estos estados a otro diferente decimos que ha sufrido un cambio de estado».
El cambio de estado se puede conseguir llevando a la materia a temperaturas extremas y/o a presiones extremas para cada estado.
Estas presiones o temperaturas extremas en cada estado, que dependen del tipo de materia, se llaman temperaturas o presiones de cambio de estado.
Por ejemplo el agua a presión atmosférica a 100ºC pasa de líquido a gas. 100ºC sería su temperatura de cambio de estado de líquido a gas (temperatura de vaporización).
La mayoría de las veces el cambio de estado se produce para una presión fija (por ejemplo la presión atmosférica) y llevando a la materia a su temperatura de cambio de estado para esa presión fija.
¿Cómo se llaman los Cambios de Estados?
Nada mejor que verlo en forma gráfica y luego explicarlos. En la siguiente imagen puedes ver todos los cambios de estado de la materia.
Fíjate en la dirección de la flecha y el color para tener claro cada cambio de estado y si necesita frio o calor para producirse el cambio.
La presión a la que se encuentre la materia también influye en el cambio de estado, pero luego lo veremos.
Por ejemplo, si pasamos de líquido a gas se llamará vaporización. Si cambiamos de sólido a líquido se llamará fusión y al revés solidificación.
Los puntos (temperaturas) a las que cambian de estado se llaman punto de….
Por ejemplo, punto de fusión del oxígeno, punto de sublimación del hidrógeno, etc.
¿Y donde esta la ebullición?
En la vaporización, paso de líquido a gas, existen dos tipos diferentes, o dos formas de hacer el cambio de estado: Ebullición y evaporación.
Ebullición: cuando el cambio de estado se produce de forma rápida.
En este caso se hace llegando a la temperatura de ebullición, por ejemplo el agua es de 100ºC.
Este agua pasará de estado líquido a solido rápidamente.
Vaporización: cuando el cambio de estado se produce de forma lenta.
Si dejamos un vaso de agua en la ventana, al cabo de un tiempo este agua se evapora, es decir pasa de líquido a gas, pero el proceso lo ha realizado lentamente, sin llegar a la temperatura llamada de ebullición.
Para este caso no es necesario que lleguemos a la temperatura de ebullición del a sustancia.
Para saber más visita: Líquido a Gas
Un punto curioso es el llamado Punto Triple de la Materia, punto de la Presión y Temperatura donde pueden convivir los 3 estados a la vez.
Para saber más sobre este punto visita: Punto Triple.
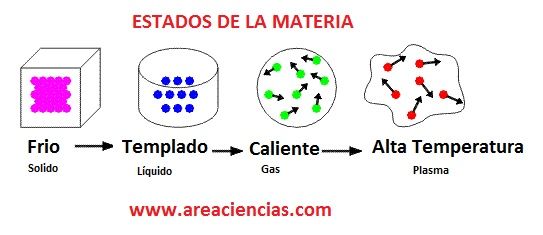
Estados de la Materia
Para estudiar los cambios de estado y los estados de la materia se elaboró una teoría que dice que la materia está formada por partículas invisibles al ojo humano, llamadas átomos o moléculas.
Existen unas fuerzas de atracción que las mantienen mas o menos unidas.
Estas partículas están en continuo movimiento, por eso la teoría se llama teoría cinética.
Fíjate como estarían las partículas en cada estado y luego lo explicamos:
Gas
Las partículas no tiene fuerza de unión por lo que el conjunto no tienen ni forma ni volumen definido.
Las partículas están libres. Su volumen es el mismo que el recipiente que lo contiene.
El mismo gas si lo cambiamos de recipiente, cambiará su volumen.
Las partículas se mueven a gran velocidad.
Líquido
Las partículas están unidas por una pequeña fuerza de atracción, por lo que el conjunto ya tiene un volumen definido, pero las fuerzas son tan débiles que no tiene forma definida. Se mueven pero lentamente.
Solido
Las partículas están muy cerca unos de otras formando un bloque compacto, teniendo muy poco espacio para moverse.
Es el estado en el que las partículas tienen mayor fuerza de atracción entre ellas. Las partículas en estado sólido no se mueven. Tiene volumen y forma definida y fija.
¿Solo tiene 3 estados posibles la materia?
La respuesta es No. Hay un cuarto estado llamado PLASMA.
Este estado lo alcanza la materia cuando está a grandes temperaturas, y se diferencia del gaseoso por que en este estado la velocidad de los átomos es tan grande que al chocar entre ellos y por la elevada temperatura se liberan electrones de sus átomos quedando en forma de iones + y electrones libres y con un movimiento a una gran velocidad y sin orden aparente.
Este estado no es muy estudiado pero resulta que en el universo (no en la tierra) el 99% de la materia esta en estado de plasma.
Esto es como esta la materia por ejemplo del sol y de la mayoría de las estrellas.
Estado de plasma: materia en forma de electrones que se han separado de sus átomos convirtiéndose en aniones + moviéndose a gran velocidad. Si quieres saber más vete ha este enlace: Estado Plasma.
¿Qué necesitamos para Cambiar de Estado?
Conseguiremos un cambio de estado, si somos capaces de debilitar o aumentar la fuerza de unión de las partículas y/o aumentar o disminuir su movimiento.
Si está en estado sólido y conseguimos que se debilite la fuerza de unión entre sus partícula, llegará un momento que se convertirá en líquido, si se sigue debilitando, hasta que no haya fuerza de unión, pasará a estado gaseoso.
El proceso es reversible.
Pero…. ¿Cómo conseguimos esto?.
Cambiando la Presión y/o la Temperatura de la sustancia.
El estado de una sustancia está determinado por su temperatura y por la presión a la que se encuentra.
El aumento de temperatura provoca disminución de las fuerzas de unión de las partículas, haciendo que tengan más libertad de movimiento.
El frío provoca aumento de esas fuerzas de unión y disminución de movimiento.
El aumento de presión, provoca que las partículas se junten y por lo tanto aumente la fuerza de atracción entre ellas.
La disminución de la presión provoca que las partículas se alejen, disminuyendo la fuerza de unión entre ellas.
Por ejemplo, el oxígeno se solidificará a -361,8 grados Fahrenheit (-218.8 grados Celsius) a presión estándar (20ºC). Sin embargo, se congelará a temperaturas más altas cuando se aumenta la presión.
Ejemplos de Cambios de Estados
Si calentamos un sólido llegará un momento que se convertirá en líquido, si lo seguimos calentando, llegará un momento que pasará de líquido a gas.
El proceso es reversible, es decir si ahora enfriamos el gas, llegará un momento que se convierta en líquido y si lo seguimos enfriando se volverá a convertir en sólido.
Con la presión pasa lo mismo. Imagina que tienes un líquido a una presión determinada. si aumentamos su presión, los átomos de sus moléculas se juntarán cada vez más debido a la presión. Aumentando su presión llegará un momento que se convertirá en sólido.
Si ha ese líquido lo disminuimos su presión, llegará un momento que los átomos estarán más libres y se convertirá en gas.
Como conclusión diremos que la temperatura y la presión son los dos factores que intervienen en el cambio de estado de la materia.
Normalmente los cambios de estado se estudian dejando la sustancia a presión constante y aumentando o disminuyendo la temperatura.
Temperaturas y Cambios de estado
La temperatura a la que una sustancia cambia de estado se llama temperatura de….seguido del nombre del cambio de estado.
Por ejemplo la temperatura de fusión del agua es 100º, que es la temperatura a la que el agua pasa de solido a líquido.
La temperatura de solidificación del agua es de 0ºC, que es la temperatura a la que el agua pasa de líquido a sólido.
En lugar de temperatura también se suele llamar punto de…, por ejemplo punto de fusión.
Cada tipo de sustancia diferente, tiene sus propias temperaturas a las que cambia de estado.
Por ejemplo el alcohol puro tiene un punto de solidificación de -117ºC, por eso el alcohol es un estupendo anticongelante ¡se congela a -117ºC! Por contra tenemos el hierro, que su temperatura de fusión es de 1539ºC.
Por debajo de esa temperatura estará en estado sólido.
Aquí tienes una tabla con diferentes puntos de cambios de estados de varios sustancias diferentes:
Si te ha gustado pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.