Una piedra y un metal los dejamos al sol y al cabo de un tiempo el metal se calentará mucho más que la piedra.
¿Por qué?
Porque no todos los cuerpos se calientan de la misma forma. y el calor especifico es la propiedad de los cuerpos que mide esa diferencia.
Indice de Contenidos
¿Qué es el Calor Específico?
Es la capacidad de los materiales para almacenar el calor en relación con su peso.
Se define por la cantidad de calor que se necesita aplicar a 1 kg de material para elevar su temperatura en 1°C.
Unidades del Calor Específico
Se mide, o lo que es lo mismo su unidad de medida en el sistema internacional (SI) es el Joule/Kg x ºK
Siendo la unidad de energía el Joule (J), la de la masa el Kilogramo (Kg) y la de la temperatura el grado Kelvin (ºK)
Como estamos más acostumbrados a trabajar con grados Celsius (ºC) muchas veces lo medimos y lo veremos en Joule/kg.°C
Cualquiera de estas unidades la podemos poner en otros múltiplos o submúltiplos de ellas mismas.
Por ejemplo, los Kilogramos los podemos expresar en gramos, o los Joules en calorías.
Podemos encontrarnos con unidades de calor específico de Kilocalorias/Kg x ºC
Imagina que decimos que el agua tiene un calor especifico de 1 cal/gr ºC, que es cierto, estamos diciendo que hace falta una caloría para elevar la temperatura de un gramo de agua en un grado Celsius.
Esta cifra equivale a 4186 Julios/gramo ºC
Por ejemplo, el calor específico del acero es de 502 julios por kilogramo y kelvin.
Esto significa que se necesitarán 502 julios de energía para que un kilogramo de acero aumente su temperatura en un kelvin.
Aquí te dejamos la relación entre un tipo de escala de temperatura y otra, por si no lo recuerdas.
A veces se llama capacidad calorífica, en lugar de calor específico, pero es lo mismo.
Hay que decir que en general, el calor específico de una sustancia depende de la temperatura a la que se encuentra dicho material.
No es la misma cantidad de energía necesaria para elevar la temperatura un grado, sea Kelvin o Celsius, si el material está a 0º que si está a 200º centígrados.
Sin en embargo, como esta dependencia de la temperatura no es muy grande, el calor específico de un material suele tratarse como una constante.
Calcular el Calor Específico
El calor (representado con la letra Q) es la energía transferida de un sistema a otro (o de un sistema a sus alrededores) debido en general a una diferencia de temperatura entre ellos.
Dos o más cuerpos en contacto que se encuentran a distinta temperatura, alcanzarán con el pasado del tiempo el equilibrio térmico, es decir la misma temperatura.
Por lo tanto, un cuerpo deberá ceder su calor o su frío al otro cuerpo.
La cantidad de calor (Q) necesaria para variar la temperatura de una masa (m) de una sustancia es proporcional al cambio en su temperatura (∆T) y a dicha
masa.
Matemáticamente se expresa:
Q=m x c x ∆T
(Tf-Ti)
Donde m es la masa, c es el calor específico, y ∆T es el incremento de temperatura.
Si Ti es la temperatura inicial y Tf la temperatura final
∆T = (Tf-Ti)
La fórmula la podríamos poner cómo:
Q=m x c x (Tf-Ti)
Acuérdate que:
Si Ti > Tf el cuerpo cede calor Q<0
Si Ti < Tf el cuerpo recibe calor Q>0
Normalmente el calor absorbido por un cuerpo será positivo y el calor cedido negativo.
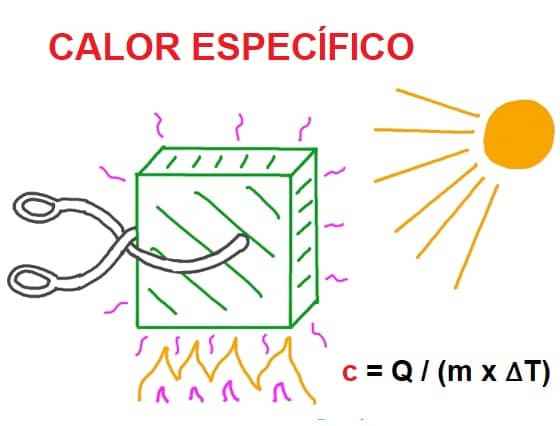
No hay fórmula específica para calcular el calor específico de una sustancia, pero con esta fórmula podemos calcularlo simplemente despejándolo.
c = Q / (m x ∆T)
Puedes ver la letra c para el calor específico como Ce en muchos libros.
En muchas ocasiones resulta más útil describir una sustancia en términos del número de moles n, en vez de la masa m de la misma, sobre todo en química.
Recordando que la masa de una sustancia se puede relacionar con el número de moles de la siguiente forma:
m = nM
Donde M es la masa molar de la sustancia y se define como la masa por mol.
n = Número de moles de la sustancia
m = masa de la sustancia.
A partir de la definición anterior se puede reescribir la expresión de la cantidad de calor (Q) necesaria para variar la temperatura de una masa de una sustancia de la siguiente manera:
Q = n x M x c x ∆T = n x C x ∆T
Donde
C = son los números de moles por la capacidad calorífica (M x c) y se conoce como capacidad calorífica molar y representa la cantidad de calor necesaria para elevar en 1◦C la temperatura de 1 mol de una
sustancia.
Las unidades del calor específico, expresado en moles en el SI son J/(mol·K) o J/(mol·C.
Calor Especifico de las Sustancias Más Importantes
Aquí te dejamos una tabla, incluso también la capacidad calorífica molar de la que hablamos antes:
Ejercicios
Se utilizan 8360 J para calentar 600 g de una sustancia desconocida de 15°C a 40°C. ¿Cuál es el calor especifico de la sustancia?.
Solución:
c = Q / (m x ∆T)
∆T = 40 – 15 = 25ºC
Q = 8360 Julios
m = 600 gamos = 0,6Kg
c = 8569 Julios/ ( 0,6Kg x 25º) = 557,3 J/ Kg ºC
Para determinar el calor específico de un metal, se introducen 50 g del mismo a 15ºC en un calorímetro junto con 100 cm3 de agua a 90ºC.
El equilibrio se alcanza a 70ºC.
Por otra parte, se ha efectuado una prueba previa para determinar la capacidad calorífica del calorímetro, introduciendo en él 100 cm3 de agua a 90ºC siendo la temperatura del calorímetro 60ºC, alcanzándose el equilibrio a 85ºC.
a) ¿Cuál es la capacidad calorífica del calorímetro?
b) Hallar el calor específico del metal.
Solución:
El Agua y su Calor Específico
Sabemos que si se transfieren 4182 julios de energía a un kilogramo de agua a temperatura ambiente, esta cantidad de agua aumentará su temperatura en un grado.
De esto podemos deducir que el valor del calor específico del agua es igual a 4182 julios por kilogramo y grado.
El agua es la sustancia con el mayor calor específico.
Si en verano ponemos un estanque con agua a pleno sol, se puede calentar y calentar.
Sin embargo, no elevará su temperatura lo suficiente como para hervir o cocinar huevos en él.
Por otro lado, si colocamos una barra de metal, es probable que no puedas cogerla porque su temperatura será tan alta que se quemará.
Su importancia también se transmite en la meteorología.
El hecho de que el agua tenga esta elevada capacidad calorífica anual es un hecho curioso si no una propiedad importante que contribuye en particular a regular el tiempo y el clima en general.
Al tener este calor específico tan alto, sabemos que grandes masas de agua son las responsables de regular las fluctuaciones extremas de temperatura en todo el planeta.
De lo contrario, el clima probablemente no tendría las mismas características que el que conocemos hoy en día.
Si te ha gustado la página sobre el Calor Específico pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.