El ácido nítrico HNO 3 es uno de los ácidos inorgánicos más importantes.
Como componente principal de los fertilizantes, es una de las materias primas químicas más producidas en el mundo y su demanda seguirá creciendo en las próximas décadas.
También se utiliza para la creación de explosivos, por ejemplo, para la nitroglicerina y trinitrotolueno (TNT).
Indice de Contenidos
¿Qué es el Ácido Nítrico?
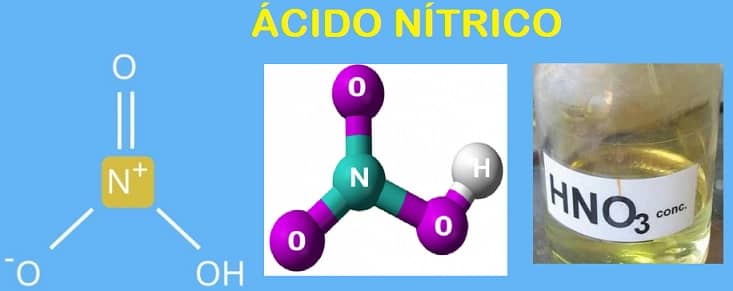
El ácido nítrico, también llamado nitrato de hidrógeno según la nomenclatura IUPAC o agua de separación, es un ácido altamente corrosivo del elemento nitrógeno.
Esto significa que el grupo ácido (-OOH) no está unido a un átomo de carbono (C) como en otros ácidos, sino a un átomo de nitrógeno (N), siendo es el oxiácido de nitrógeno más conocido y más estable
Puedes ver esto a partir de su fórmula: HNO 3 .
El HNO 3 se utiliza, por ejemplo, para la producción de explosivos, colorantes o fertilizantes.
Las sales neutras del ácido nítrico se llaman nitratos.
Propiedades del Ácido Nítrico
En la siguiente tabla tienes algunas propiedades del ácido nítrico resumidas, las más importantes, pero detrás tienes algunas más.
En estado puro, el ácido nítrico es incoloro, sin embargo, el ácido nítrico concentrado se descompone fácilmente (especialmente cuando se expone a la luz) y, a menudo, tiene un tono amarillento o rojizo debido al dióxido de nitrógeno (NO 2 ) disuelto en él.
Es un líquido incoloro con un olor extremadamente acre y es corrosivo pero si se almacena durante un período de tiempo largo, se vuelve amarillo bajo la influencia de la temperatura, debido a la descomposición espontánea en óxidos de nitrógeno y agua.
Reacciona fácilmente con muchas sustancias y genera calor cuando se disuelve en agua, siendo incluso varias de estas reacciones explosivas.
El ácido nítrico ordinario tiene una concentración del 68%, pero cuando la solución contiene más del 86 % de HNO3, se denomina ácido nítrico fumante, ácido que tiene un fuerte efecto oxidante y puede encender algunas sustancias fácilmente combustibles.
Como resultado de mezclar ácido nítrico con ácido clorhídrico en una proporción de 1: 3, se forma el llamado agua regia, que puede disolver incluso metales preciosos, incluso el oro y el platino.
Peligros
El ácido nítrico concentrado es extremadamente peligroso para la salud.
En contacto con la piel provoca graves quemaduras e incluso necrosis.
En forma de vapores, ingresa al tracto respiratorio y causa edema pulmonar y neumonía.
El consumo accidental de HNO 3 puede provocar la muerte por perforación del estómago o de la pared intestinal.
Cuando se manipule ácido nítrico concentrado, se requiere el uso de equipo de protección personal.
Cualquier persona que entre en contacto con el ácido debe usar un respirador, gafas de seguridad y ropa y guantes resistentes al ácido.
Se recomienda lavar bien las manos y la cara después del trabajo y aplicar crema protectora en la piel.
Debido al carácter explosivo de las reacciones y de las mezclas resultantes, así como a los riesgos excepcionales para la salud, el ácido nítrico requiere un cuidado especial en su almacenamiento y uso.
Según la normativa ADR para el transporte de mercancías peligrosas, debe transportarse en cisternas de aluminio o camiones cisternas con el marcado correspondiente.
Se debe de utilizar recipientes especiales resistentes al ácido nítrico para almacenar ácido nítrico.
Estos deben estar debidamente cerrados y almacenados lejos de la luz solar directa a una temperatura inferior a 20 °C.
No debe haber materiales metálicos o inflamables cerca y la habitación o habitáculo donde se almacena debe estar bien ventilada.
La liberación accidental de ácido en el medio ambiente representa un peligro para los seres humanos, los animales y las plantas, por lo que se debe evitar a toda costa que el ácido entre en las aguas superficiales y subterráneas.
Los derrames deben limpiarse inmediatamente con material absorbente o mediante bombeo.
El ácido nítrico es una materia prima ampliamente utilizada y juega un papel importante en las industrias de fertilizantes, explosivos y plásticos, sin embargo, los beneficios asociados con su uso no deben eclipsar los riesgos potenciales.
El cumplimiento responsable de la normativa vigente es la mejor forma de evitar accidentes con riesgo de vida.
Aplicaciones del Ácido Nítrico
Cuando el ácido nítrico se neutraliza con amoníaco, se forma nitrato de amonio, el componente más importante de los fertilizantes minerales utilizados en todo el mundo.
sirve para aporta a las plantas el nitrógeno que necesitan para su crecimiento, en grandes dosis y de fácil absorción.
Además, el HNO 3 se puede utilizar para la acidificación del suelo en la horticultura.
En la industria química, el ácido nítrico es principalmente un precursor de compuestos orgánicos nitrogenados, como Nitrobencenos.
Conjuntamente con los compuestos aromáticos se obtienen sustancias para la elaboración de explosivos como el TNT o la nitroglicerina.
Otra aplicación importante es el combustible para cohetes en la industria espacial debido a la posibilidad de un almacenamiento muy eficiente.
Para ello se prepara una mezcla de HNO 3, tetróxido de dinitrógeno y peróxido de hidrógeno, también conocido como ácido nítrico fumante rojo.
También cabe mencionar el potencial del ácido nítrico en el campo de la producción de plásticos.
La oxidación que provoca produce ácido adípico, que se utiliza en la fabricación de fibras sintéticas como el nailon.
Otra área de aplicación del ácido nítrico es el tratamiento superficial de metales, es decir, decapado o grabado, p. B. de acero inoxidable.
Las sales de ácido nítrico, los nitratos, se utilizan como explosivos o en fuegos artificiales. El primer explosivo conocido, la pólvora negra , es una mezcla de 75% de nitrato de potasio, 10% de azufre y 15% de carbón en polvo.
Además, se utiliza en una prueba colorimétrica para distinguir heroína y morfina.
En el campo de la medicina, el ácido nítrico se utiliza en estado puro como cáustico para eliminar chancros y verrugas. Las soluciones diluidas se utilizan en el tratamiento de la dispepsia.
Otros usos más especializados del ácido nítrico son:
- Fabricación de tintes y barnices orgánicos.
- Industria farmacéutica.
- Fabricación de fungicidas.
- Limpieza y grabado de superficies metálicas.
- Refinación de metales preciosos en la industria de la joyería.
- Envejecimiento artificial de la madera para obtener los tonos deseados.
- Fabricación de productos de limpieza para uso doméstico.
- Detección de trazas de metal en las sustancias examinadas.
Fabricación del Ácido Nítrico
El ácido nítrico técnico con una concentración de 52 a 68% se produce según el método de Ostwald en 3 pasos:
Brevemente, consiste en la oxidación catalítica de amoníaco sobre una rejilla de platino o platino-rodio (requiere una alta temperatura de 227°C y una alta presión de hasta 9 atm.).
A su vez, el propio amoníaco para los fines de este proceso se obtiene por síntesis directa de hidrógeno y nitrógeno (reacción de Haber y Bosch).
El primero en formarse es el óxido nítrico (II), que se oxida a óxido nítrico (IV) en presencia de aire.
El óxido nítrico así obtenido se somete luego a una desproporción en agua, con lo que se obtienen ácido nítrico y ácido nitroso.
Debido al hecho de que el ácido nitroso no tiene una alta estabilidad, se produce una mayor desproporción.
Finalmente se obtiene una solución acuosa de ácido nítrico por destilación de toda la decocción hasta un nivel del 68%.
Su concentrado se puede obtener por deshidratación con ácido sulfúrico concentrado.
Ejercicios Ácido Nítrico
1º) Se dispone de un ácido nítrico comercial del 96,73 % en peso y 1,5 g/ml de densidad
¿Cuántos ml del ácido concentrado serán necesarios para preparar 0,2 litros de disolución 1,5 Molar de dicho ácido?
Peso molecular del HNO3 = 63.
2º)