Vamos a ver que son los enlaces covalentes, como se forman y sus características con ejemplos y de forma fácil.
Indice de Contenidos
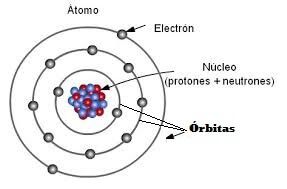
Recordamos el Átomo
Lo primero es recordar que los átomos están formados por protones, neutrones y electrones.
Estos últimos, los electrones, tienen carga negativa y son los que entran en juego en los enlaces covalentes, por lo tanto, son los únicos que nos interesan para su estudio.
Los electrones están girando en órbitas alrededor del núcleo del átomo, llamadas orbitales, capas o niveles de energía.
También recordar que los átomos se pueden unir formando lo que se llama un enlace químico y precisamente, estos enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
¿Cómo se unen los Átomos?
Una de las formas de unión es formando enlaces covalentes que son los que explicaremos aquí.
Cuando dos átomos se unen, ceden, aceptan o comparten electrones, pero solo los llamados «electrones de valencia» pueden hacer esto, ser cedidos, ser cogidos o compartidos por otro átomo.
Los electrones de valencia son los que se encuentran en la última capa del átomo y son los únicos que están dispuestos a dejar compartirse con otro átomo.
Cuando dos átomos se unen siempre cumplen la llamada regla del octeto.
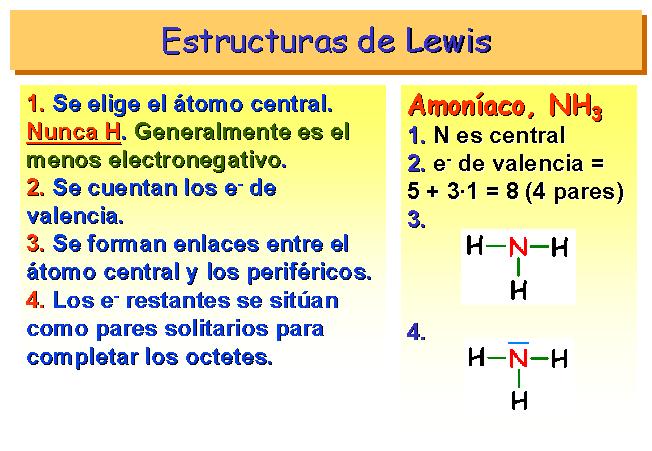
Regla del Octeto
La regla del octeto, también llamada ley de Lewis, dice que todos los átomos de los elementos del sistema periódico, tienden a completar sus últimos niveles de energía (capas) con una cantidad de 8 electrones.
Son los electrones de la última capa, los más alejados del núcleo, los que tienden a completarse hasta ser un total de 8 electrones y, para ello, compartirán electrones con otro átomo si es necesario.
OJO, Los gases nobles son los únicos no reactivos (no reaccionan o comparten con nadie), porque ya tienen 8 electrones en su última capa. No comparten más.
Esta combinación de los electrones de la última capa entre átomos se puede hacer de varias formas, una de ellas es el enlace covalente.
El Enlace Covalente
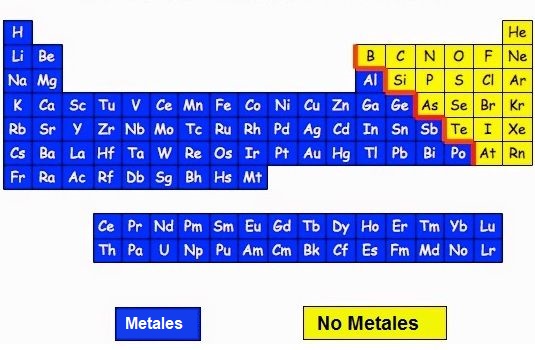
Los enlace covalentes están formados por átomos NO METALICOS.
Recuerda enlace (átomos que comparten electrones y por lo tanto están enlazados)
Los elementos de la derecha del todo de la tabla períodica son los elementos NO metálicos (color amarillo). Solo estos pueden formar los enlaces covalentes.
Los átomos No metálicos suelen tener muchos electrones girando en su última órbita (llamados electrones de valencia) por lo que tienden a ganar (coger) electrones de otro átomo en lugar de cederlos para tener los 8 electrones de la regla del octeto y tener la estabilidad de los gases nobles (tener 8 electrones de valencia).
El problema es que como los dos átomos están en este caso, los dos son no metales, ninguno de los dos querrá ceder sus electrones al otro.
¿Qué implica esto?
Pues que estos átomo, los no metales, como no quieren desprenderse de electrones, al encontrarse o unirse, lo que harán será compartir electrones de su última capa, en lugar de ceder o ganar electrones, que sería el caso de los enlaces iónicos.
Conclusión: los átomos no metálicos no pueden ceder ni ganar electrones entre si, si no que los comparten.
«Los enlaces covalentes se forman entre dos No Metales y compartiendo electrones de valencia«.
Cuando se unen dos átomos no metálicos, los electrones que comparten los mantienen unidos y forman parte de los dos átomos, formando así una molécula (varios átomos unidos). Una vez unidos, los dos átomos adquieren la estructura de los gases nobles con 8 átomos.
Pueden estar unidos por enlaces sencillos, dobles o triples, dependiendo de los electrones que compartan en la unión.
Formación de los Enlaces Covalentes
Veamos un ejemplo de formación de enlaces covalentes.
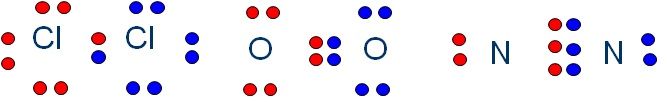
El Cloro es un NO metal. El cloro en estado natural se presenta en Cl2, es decir una molécula de cloro de 2 átomos. Los dos átomos de cloro están unidos mediante un enlace covalente.
El cloro tiene 7 electrones en su última capa, por lo tanto si comparten uno de estos electrones cada uno , en la molécula ya tendrían 8 electrones cada uno.
Perfecto han formado una molécula con dos átomos muy estables. Este enlace solo necesita compartir un electrón cada uno para formar el octeto.
Aquí lo puedes ver:
Otro caso es el de la molécula de oxígeno O2. Cada átomo de oxígeno tiene 6 electrones de valencia, con lo que tendrán que compartir 2 electrones cada uno para llegar al octeto.
Los enlaces covalentes pueden compartir 1, 2 o 3 electrones de valencia. Se llaman enlaces simples, dobles o triples. Aquí tienes un ejemplo de cada uno de ellos: Cl2, O2 y N2.
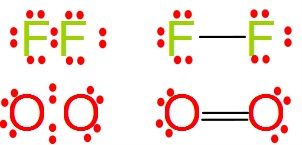
Normalmente estos enlaces de forma escrita se expresan poniendo un redondelito por cada electrón de valencia de cada átomo y una rayita por cada uno de los electrones compartidos en el enlace. Mira estos dos ejemplos:
El F2 comparten 1 electrón, pues una rayita, el O2 comparten 2 electrones, pues 2 rayitas. El primero es simple y el segundo doble. Ya sabes existen hasta enlaces triples.
La pregunta es ¿Cómo sé cuantos electrones de valencia tiene un átomo cualquiera?
Eso se llama configuración electrónica del átomo y puedes saberlo si vas al siguiente enlace: Configuración Electrónica. Otra forma sencilla es conocer las familias de la tabla periódica, y también sabrás los electrones de valencia.
Si sabemos la configuración electrónica de los no metales que forman el enlace covalente, ves que es muy fácil ver como es el enlace covalente.
En la tabla periódica de los elementos a veces también viene especificado el número de electrones de valencia de cada átomo.
Vamos a ponerte un ejercicio, tranquilo con la solución, poco a poco te la diremos.
¿Determina en las siguientes uniones covalentes si el enlace que se forma es sencillo doble o triple?
N2 , I2 , O2 , Br2
Solución:
N2= El nitrógeno tiene 5 electrones de valencia, teniendo en cuenta que todos los átomos buscan tener el estado de valencia mas estable que es el octeto, este formará un triple enlace.
I2= Un enlace sencillo porque tienen 7 electrones de valencia.
H2=Enlace sencillo, el hidrogeno es una excepción a la regla del octeto y este solo busca tener dos electrones en su ultimo nivel de energía.
O2= Un doble enlace ya que tiene dos electrones de valencia.
Br2=Forma un enlace sencillo ya que tiene 7 electrones de valencia.
Hasta aquí los enlaces covalentes más sencillos, pero los hay un poco más complejos.
Veamos un enlace de 3 no metales el CO2 o dióxido de carbono. Tiene la siguiente expresión O=C=O. ¿Por qué?
El oxígeno tiene 6 enlaces de valencia, y el cloro 4. ¿Cómo forman el enlace covalente? Pues el cloro comparte su 4 electrones de valencia con los otros dos átomos de oxígeno, así los átomos de oxígeno tienen 8 electrones. Esto es algo más difícil.
Este tipo de enlaces se llaman enlaces covalentes coordinados o dativos: Es un enlace covalente en el que el par de electrones que se comparte es aportado por un solo átomo ( en nuestro caso el carbono). A los compuestos con este tipo de enlace se llaman complejos.
Para formar este tipo de enlaces hay que saber la llamada estructura de lewis que es una interpretación de la covalencia.
La electronegatividad es la capacidad para traer los electrones.
En la tabla periódica de arriba hacia abajo en un grupo la electronegatividad desciende mientras que en un periodo de izquierda a derecha la electronegatividad aumenta.
Además existe una tabla de electronegatividad con los números concretos de electronegatividad de cada átomo.
Otro ejemplo es la molécula de agua H2O.
Un átomo de oxígeno tiene seis electrones en la última capa, por lo que le faltan dos para completarla. Es por ello que se une con dos átomos de hidrógeno, cada uno de los cuales aporta su único electrón.
El resultado es que se forma una molécula de agua en la que existen dos enlaces covalentes oxígeno-hidrógeno.
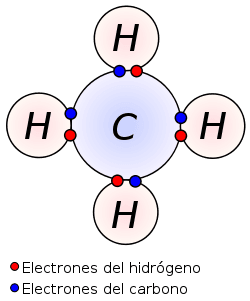
Fíjate en este imagen:
Este es un enlace covalente triple, formado por 3 átomos. Como ves en este caso hay un átomo llamado central, en este caso el carbono. Este átomo tiene 4 electrones de valencia que compartirá uno con cada átomo del hidrógeno para tener 8 electrones, formando una nube de electrones que comparte la molécula.
Ejemplos de Enlaces Covalentes
Molécula de Agua (H2O), Amoniaco (NH3), H2 (gas dihidrógeno), O2 (gas oxígeno), Cl2 (gas cloro), Br2 (bromo elemental), N2 (gas nitrógeno), CH4 (metano), C2H6 (etano), S8 (azufre rómbico), P4 (fósforo blanco) y NF3 (fluoruro de nitrógeno).
Características de los Enlaces Covalentes
– Los compuestos covalentes pueden presentarse en cualquier estado de la materia: solido, liquido o gaseoso.
– Son malos conductores del calor y la electricidad.
– Tienen punto de fusión y ebullición relativamente bajos.
– Son solubles en solventes polares como benceno, tetracloruro de carbono, etc., e insolubles en solventes polares como el agua.
También Te Puede Interesar:
–Ejercicios Configuración Electrónica
Si te ha gustado pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.

me agrada la información, es clara y precisa. gracias
Todos esta bien ya que habla de las características de los enlaces covalente y se entiende muy claro
Por años e errado en sacarle la vuelta a esta
Ciencia, tan importante a la vida, no más y haun tengo vida a los 70 y mas años para aprender, gracias , Díos les bendiga
Hola, soy Jhannet Guerrero, me gusta como explican de forma fácil, me gustaría aprender toda la química tanto la inorgánica como la orgánica, con ustedes