Vamos a ver qué es un modelo atómico y los diferentes modelos atómicos a lo largo de las historia, Demócrito, Dalton, Bohr, etc.
Indice de Contenidos
¿Qué es un Modelo Atómico?
Cuando hablamos de “modelo” hablamos de una representación o esquema de forma gráfica que nos sirve como referencia para entender algo de forma más sencilla.
Cuando hablamos de “atómico” hablamos de conceptos relacionados con los átomos.
Según esto: «un modelo atómico es una representación gráfica de la estructura que tienen los átomos».
Un modelo atómico representa una explicación o esquema de cómo son y cómo se comportan los átomos.
La materia está compuesta por estas partículas pequeñas e indivisibles que llamamos átomos y esos átomos tienen un comportamiento determinado y unas propiedades determinadas.
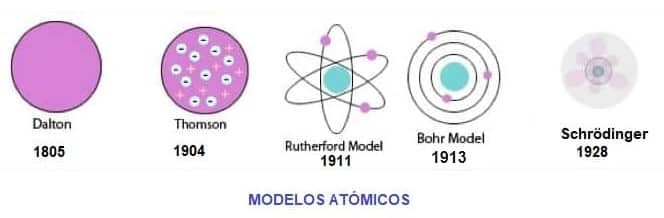
A lo largo de nuestra historia se han elaborado diferentes modelos atómicos que tienen el nombre de su descubridor.
Estos modelos fueron mejorando el concepto real del átomo hasta llegar al actual modelo atómico presentado por Sommerfeld y Schrödinger.
En esta página explicaremos la evolución de los modelos atómicos.
Al final tienes un esquema resumen de todos.
Cuando acabes de ver todos los modelos te recomendamos: Ejercicios Sobre Modelos Atómicos.
Un ejercicio para hacer online de repaso.
Historia de los Modelos Atómicos
Es importante darse cuenta de que mucho de lo que sabemos sobre la estructura de los átomos se ha desarrollado durante un largo período de tiempo.
A menudo es así como se desarrolla el conocimiento científico, con una persona basándose en las ideas de otra persona.
Vamos a ver cómo nuestra comprensión moderna del átomo ha evolucionado con el tiempo.
Modelo Atómico De Demócrito de Abdera
Este fue el primer modelo atómico, inventado por el filósofo griego Demócrito de Abdera que vivió entre los años 460 al 370 a.c (antes de Cristo).
Demócrito fue el desarrollador de la “Teoría Atómica Del Universo”.
Fue el primer filósofo-científico que afirmó que los átomos son eternos, inmutables e indivisibles, es decir, que duran siempre, que no cambian y que no pueden dividirse en partículas más pequeñas.
Para Demócrito el átomo era la partícula más pequeña que había, una partícula homogénea, que no se puede comprimir y que además no se podía ver.
Su teoría era filosófica, no científica.
De hecho la palabra “átomo” proviene del griego “á-tómo” que significa “sin división”.
Modelo Atómico De Dalton
John Dalton fue un químico y matemático británico (entre otras muchas cosas) que vivió durante los años 1766 y 1844, de donde procede la palabra “Daltonismo”.
Seguro que sabrás que las personas daltónicas son aquellas que les es muy difícil distinguir los colores por un defecto genético.
Esto te lo contamos como curiosidad ya que fue Dalton quien escribió sobre esto porque él mismo lo padecía.
Aparte, fue el primero en desarrollar un modelo atómico con bases científicas.
Basándose en la idea de Demócrito, Dalton concluyó que el átomo era algo parecido a una esfera pequeñísima, también indivisible e inmutable.
Dalton hizo los siguientes “postulados” (afirmaciones o supuestos):
1. La materia está compuesta por partículas diminutas, indivisibles e indestructibles llamadas átomos.
2. Los átomos de un mismo elemento son idénticos entre sí (es decir, con igual masa y propiedades).
3.Los átomos de diferentes elementos tienen masas y propiedades distintas.
4.Los átomos permanecen sin división, incluso cuando se combinan en reacciones químicas.
5.Los átomos, al combinarse para formar compuestos (lo que hoy llamamos moléculas) mantienen relaciones simples.
6.Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
7.Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos. Para Dalton un átomo era algo así como una pequeña esfera.
Veamos una imagen del Modelo Atómico De Dalton:
Tanto Dalton como Demócrito ya se adelantaban y ya vislumbraban el Principio de Conservación de la Energía en donde nada se crea ni se destruye, pero ambos modelos tienen insuficiencias o errores que se conocieron mucho después y es que los átomos sí pueden cambiar y también pueden dividirse en partículas más pequeñas.
El átomo NO es la partícula más pequeña. Sabemos ya que existen partículas subatómicas (que significa más pequeño que el átomo) como por ejemplo los “quarks”, los “neutrinos” o los “bosones”.
Modelo Atómico De Thomson
Joseph John Thomson fue un científico británico que vivió entre los años 1856 y 1940 que descubrió el electrón y los isótopos.
Ganó el Premio Nobel de Física en 1906 y su teoría sobre el átomo decía que los átomos estaban compuestos por electrones de carga negativa en un átomo positivo, es decir, como si tuviéramos una bola cargada positivamente rellena de electrones (carga negativa).
También conocido como Modelo del Pudin De Pasas porque parece un bizcocho relleno de pasas.
Veamos una imagen del Modelo Atómico De Thomson:
La electricidad fue lo que ayudó a Thomson a desarrollar su modelo.
El error que cometió Thomson fue que hizo suposiciones incorrectas de cómo se distribuía la carga positiva en el interior del átomo.
Modelo Atómico Cúbico De Lewis
Gilbert Newton Lewis fue un físico y químico estadounidense que vivió entre los años 1875 y 1946 que realizó numerosos trabajos científicos de los cuáles se destacan la “Estructura De Lewis” también conocida como el “Diagrama De Punto”.
El modelo atómico de Lewis está basado en un cubo, donde decía que los electrones de un átomo se colocaban de forma cúbica, es decir, los electrones de un átomo estaban colocados en los vértices de un cubo.
Gracias a ésta teoría se conoció el concepto de “valencia de un electrón” es decir, esos electrones en el último nivel de energía de un elemento que pueden reaccionar o enlazarse con otro elemento.
Veamos una imagen del Modelo Atómico Cúbico De Lewis:
El modelo de Lewis fue un paso importante en la historia para entender el significado del átomo pero se abandonó pronto esta teoría.
Modelo Atómico De Rutherford
Ernest Rutherford fue un químico y físico neozelandés que vivió entre los años 1871 y 1937 que dedicó gran parte de su vida a estudiar las partículas radioactivas (partículas alfa, beta y gamma) y fue el primero de todos en definir un modelo atómico en el que pudo demostrar que un átomo está compuesto de un núcleo y una corteza.
Ganó el Premio Nobel De La Química en 1908.
Para Rutherford el átomo estaba compuesto de un núcleo atómico cargado positivamente y una corteza en los que los electrones (de carga negativa) giran a gran velocidad alrededor del núcleo donde estaba prácticamente toda la masa del átomo.
Para Rutherford esa masa era muy muy pequeña.
Esa masa la definía como una concentración de carga positiva.
Los estudios de Rutherford demostraron que el átomo estaba vació en su mayor parte ya que el núcleo abarcaba casi el 100% de la masa del átomo.
Veamos una imagen del Modelo Atómico De Rutherford:
Modelo Atómico De Bohr
Este modelo también se llama de Bohr-Rutherford. Niels Henrik David Bohr fue un físico danés que vivió entre los años 1885 y 1962 que se basó en las teorías de Rutherford para explicar su modelo atómico.
En el modelo de Bohr se introdujo ya la teoría de la mecánica cuántica que pudo explicar cómo giraban los electrones alrededor del núcleo del átomo.
Los electrones al girar entorno al núcleo definían unas órbitas circulares estables que Bohr explicó como que los electrones se pasaban de unas órbitas a otras para ganar o perder energía.
Demostró que cuando un electrón pasaba de una órbita más externa a otra más interna emitía radiación electromagnética.
Cada órbita tiene un nivel diferente de energía.
Veamos una imagen del Modelo Atómico De Bohr:
Modelo Atómico De Sommerfeld
Arnold Johannes Wilhelm Sommerfeld fue un físico alemán que vivió entre los años 1868 y 1951.
La aportación más importante de este físico alemán fue cambiar el concepto de las órbitas circulares que definían los electrones en el modelo atómico de Bohr por órbitas elípticas.
Lo que hizo Sommerfeld fue perfeccionar el modelo de Bohr con las órbitas elípticas lo que dio lugar al descubrimiento del numero cuántico Azimutal (o secundario).
Cuanto mayor era este número mayor era la excentricidad de la órbita elíptica que describía el electrón.
Veamos una imagen del Modelo Atómico De Sommerfeld:
Modelo Atómico De Schrödinger
Erwin Rudolf Josef Alexander Schrödinger fue un físico austriaco que vivió entre los años 1887 y 1961 cuyo modelo cuántico y no relativista explica que los electrones no están en órbitas determinadas.
Describió la evolución del electrón alrededor del núcleo mediante ecuaciones matemáticas, pero no su posición.
Decía que su posición no se podía determinar con exactitud. Schrödinger propuso entonces una ecuación de onda que ayuda a predecir las regiones donde se encuentra el electrón, que se conoce como “ecuación de Schrödinger”.
Veamos una imagen del Modelo Atómico De Schrödinger:
Estos tres últimos modelos son los que se utilizan hoy en día para estudiar el átomo.
Como resumen, donde se ven las diferencias entre un modelo y otro, te dejamos este esquema:
Esquema de Los Modelos Atómicos
Vídeo Modelos Atómicos
Y aquí un vídeo que explica los diferentes modelos atómicos por si todavía no lo entendiste:
Ahora ya puedes hace los: Ejercicios Sobre Modelos Atómicos.
Te recomendamos el Juego para construir modelos atómicos, una forma entretenida de aprender: química átomo modelos moleculares
Si te ha gustado Modelos Atómicos pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.
Excelente resumen
Exelente resumen,es muy importante para nuestro aprendizaje
Muy buenas retroalimentacion de los diferentes tipos de átomos y sus diferentes teorías de los grandes filosolofos y científicos.
Cada uno con su diferentes formas y modelos bien constituidos desde su punto de vista de los grandes filósofos.
Muy bue aporte, para ampliar nuestro conocimiento acerca de los átomos y aprender más y así enfatizar más en esta materia. Gracias
Excelente
Muy informativo. Exelente
Extraordinario… Lo entendí a la perfección.
MIL GRACIAS…
Gracias a ti Un saludo
No esta mal pero no responde mi pregunta completa
Podía ser por su semejanza un sistema solar en miniatura. Ya que las orbitas de
los planeta también son elíptica al rededor del sol
Muy bien,pude aprender algunas dudas con este contenido.
Con este tema aprendí cosas que no sabía de la química y por otro lado se me hizo muy interesante y muy útil
aprendi bastante el tema sobre los meodelos atomicos, me ayudo a saber mas sobre el tema y cuales fueron los aporte de cada filosofo
He aprendido que un modelo atomico es la representacion estructural de un atomo que trata de explicar su comportamiento y propiedades.
Excelente
Muy educativo el ta de el modelo atomico
Me parecio muy educativo e interesante el tema sobre los modelos atomico y como estuviero de acuerdo dos figuras de la ciencias al decir o tener la miana opinion sobre los atomos
Muy bueno
Una explicación sencilla y muy elegante de un tema fascinante y complejo a la vez felicitaciones a los creadores de este.
Un modelo atómico representa una explicación o esquema de como son y como se comportan los átomos.
Excelente información
Excelente
muy bueno una explicacion muy interesante
Es muy interesante esas explicacines, son claras y precisa
Muy buena información para aprender mas del tema..
Me encantó, aprendí cosas que no sabía.
Haora entiendo
Es un resumen que habla de todo lo que con lleva la materia desde los modelos atómicos y la estructura de la materia está bien detallado
Excelente informe
Excelente material de estudio maestro Silvio Rodríguez .
se me hizo muy interesante y resolvieron las dudas que tenia sobre el respecto del tema, complementaron mis conocimientos de Bohr, Rutherford, Lewis, Dalton y de Demócrito descubrí otros dos modelos atónicos de Sommerfeld y de Schrödinger que no había estudiado
La información esta muy bien, aprendes de una manera rápida y divertida.
Muy interesante y amplíe mis conocimientos de Bhor y todos los me delos atómicos que no había estudiado
Son muy bueno lo resumen ya que a través de ello podemos aprender cada día sobre el tema evaluador
Excelente resumen
Excelente sistema educativo, y muy bien preparado, de una forma que podamos aprender y entretenernos sin aburrirnos!
Excelente, es la manera correcta para aprender y adquirir conocimiento.
Gran redacción sobre los distintos modelos del átomo y el como la humanidad con su nuevo conocimiento a ido modificando y ampliando este elemento tan importante no solo para la ciencia, sino también para nuestra vida misma.
Muy bueno los resúmenes, Así podemos a prender .
Muy preciso, gracias.
Excelente resumen, con esto pude obtener más conocimientos y aprender cosas nuevas.
Muy buen material
Este contenido puedo abrir mi conocimiento en cuanto a esta naturaleza. Ya que gracias a él pude aprender muchas cosas acerca de los modelos atómicos , los filósofos que aportaron oh descubrieron cada unos de ellos y lo que los mismos aportan en la química.
muy buenos el resumen porque pude obtener muy buen resultado, con los conocimientos y fundamentos que tiene
Es muy interesante
esta interesantes cada resumen cada párrafo gracias a cada resumen puede aprender muchas cosa diferente de los átomo
Lectura súper constructiva sobre los modelos atómicos.
Hola,
Me ha gustado leer este artículo sobre los modelos atómicos. Creo que todavía existen otros modelos atómicos aunque son menos importantes, como el de Nagaoka que complementava al de Thomson.
Estaba buscando la forma de ponerme en contacto con los editores del sitio para ofrecerme a escribir un apunte sobre el tema, pero no he encontrado ningún e-mail.
Aprovcecho también para felicitaros por el sitio en general,
Buen material…gracias
Buena , es un excelente material , ya que podemos sacarle un buen provecho sobre el tema a tratar en dicha circunstancia .
Muchas gracias 🙏
En la foto pone que el modelo de Bohr se invento en el 19013. Pero por lo demas esta bien.