El término Mol revolucionó el mundo de la química.
En esta página aprenderás que son los moles, como se calculan, numero de moles, el número de Avogadro y ejemplos resueltos de forma muy sencilla y fácil.
Indice de Contenidos
¿Qué es un Mol?
El mol es un término que se utiliza para medir, como por ejemplo el gramo para medir cualquier peso de cualquier sustancia.
El mol, por lo tanto, es una unidad de medida del Sistema Internacional (SI).
1 MOL = número de átomos o moléculas que hay en los gramos de una sustancia igual a su masa molecular o atómica.
– Átomos si está formado solo por átomos y entonces usamos su masa atómica.
– Moléculas si está formada por moléculas, entonces usamos su masa molecular.
Recuerda que la masa atómica de cada elemento viene en la tabla periódica.
Una vez conocida si masa atómica o molecular, depende cada caso, solo tenemos que pesar ese misma cantidad de una sustancia en gramos, y esa cantidad es un mol de esa sustancia.
Como luego veremos, una vez pesada la sustancia, podemos saber cuántos átomos o moléculas contiene dicha sustancia.
Un mol de cualquier sustancia nos revelará cuántas moléculas y átomos contiene dicha sustancia.
Con ejemplos lo entenderás mejor. Veamos primero dos ejemplos de sustancias formadas por átomos, también llamadas sustancias puras
Masa Atómica
Por ejemplo, sabemos que la masa atómica del Cobre (Cu) es de 63,54.
Luego un mol de átomos de cobre son 63,54 gramos de cobre.
Otro ejemplo, el Hierro (Fe) tiene una masa atómica de 55,847, pues un mol de hierro serán 55,847 gramos de hierro.
¿Y si la sustancia está formada toda ella por moléculas?.
Recuerda que las moléculas están formados por 2 o más átomos, por ejemplo el agua H2O (2 átomos de Hidrógeno H y 1 átomo de oxígeno O).
En el siguiente punto lo veremos.
Este tipio de sustancias formadas por moléculas se llaman compuestos químicos.
Masa Molecular
Una sustancia química está formada por la unión de distintos tipos de átomos mediante enlaces químicos, dando lugar a estructuras más complejas
Las sustancias químicas poseen una fórmula química que las identifica.
Por ejemplo, la fórmula química de una sustancia molecular como el tetracloruro de carbono es CCl4.
Esta fórmula indica que su molécula está formada por 4 átomos de cloro y 1 de carbono.
La masa molecular se calcula sumando las masas atómicas de los átomos que forman la molécula.
Lo veremos con un ejemplo concreto.
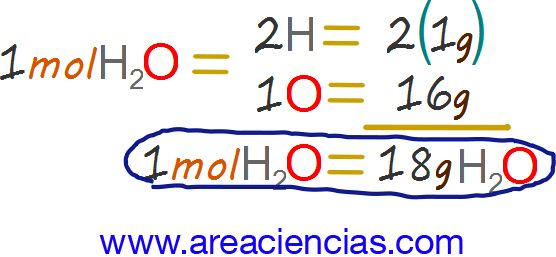
La masa molecular del agua (H2O) es de 18.
Pues un mol de agua serían 18 gramos de agua.
Masa atómica del H (hidrógeno) = 1, como tiene dos átomos de H la molécula será = 1 + 1 = 2.
Masa atómica del O (oxígeno) = 16
Total = 18 gramos de agua.
La pregunta ahora es, si tengo un mol de una sustancia…..
¿Cuántos átomos o moléculas hay en esa sustancia?
Número de Avogadro
Aquí es donde entra en juego el famoso concepto de “Número de Avogadro”.
El Número de Avogadro es nada más y nada menos que 600 mil trillones de moléculas o átomos, es decir, expresado en número es la friolera de:
600.0003000.0002000.0001000.000 = 6,022 x 1023 moléculas o átomos.
Número de Avogadro y el Mol
Pues resulta que un mol de cualquier sustancia contiene 6,022 x 1023 moléculas o átomos de esa sustancia o lo que es lo mismo contiene el número de Avogadro de átomos o de moléculas, depende si hemos usado masa atómica o molecular.
Si la sustancia está formada toda ella por átomos, el mol nos revelará el número de átomos, pero si la sustancia está formada por moléculas, por ejemplo el agua cuya molécula superconocida es H2O, el mol nos dirá cuantas moléculas de esa sustancia tenemos.
En ambos casos será el número de Avogadro.
Ahora ya debemos tener claro lo que es un mol y lo que representa.
Pero aprendamos a calcular el número de moles con algunos ejemplos y ejercicios resueltos.
Cómo Calcular Moles
Vamos a dejaros un triángulo que se suele utilizar mucho para los problemas de moles y que hace que sea todo mucha más sencillo.
En este triángulo si quieres calcular el Número de Moles será lo de arriba partido por lo de abajo, es decir, Masa total que tenemos de sustancia partido por la masa atómica o molecular de esa sustancia, las dos expresadas en gramos.
Si queremos calcular la masa total que tenemos de una sustancia, podemos hacerlo multiplicando el número de moles que tenemos por la masa atómica o molecular de la sustancia.
¿Lo entiendes?
Solo hay que fijarse en el triángulo, nos pedirán una de los 3 datos, sacaremos la solución multiplicando o dividiendo en función de como estén los datos en el triángulo.
Bueno es una forma de memorizar las fórmulas pero se puede hacer sin el triángulo perfectamente, solo hay que pensar un poco.
Ejercicios de Moles
Ejercicio 1
¿Cuántos moles están presentes en 54 g de agua?
Aplicando el triángulo:
Moles = Masa / Masa molecular (es una molécula)
Conocemos la masa pero tenemos que calcular la masa molecular de la molécula de agua.
Calculamos la masa molecular del agua que ya sabemos que su fórmula química es H2O
Masa atómica del H = 1, como tenemos dos átomos en la fórmula será 1 + 1 = 2.
masa atómica del Oxígeno = 16.
Sumando tenemos la masa molecular del agua = 18 gramos.
Aplicando la fórmula:
Moles = 54g/18g = 3 Moles de Agua.
Ahora sabrías decir cuantas moléculas de agua tendríamos en esos 54 gramos.
Fácil, si cada mol de agua tiene el número de Avogadro de moléculas, solo tendríamos que multiplicar el número de Avogadro por los moles de agua que tenemos, es decir por 3.
Y si te piden calcular el número de moles de 54 ml (mililitros) de agua.
Nos están dando la cantidad de agua en otra unidad, en este caso en volumen.
Tendríamos que convertir el volumen en gramos antes de aplicar la fórmula.
Para el agua es sencillo ya que los mililitros de volumen son igual a los gramos en peso, con lo que serían 54 gramos.
Los siguientes pasos para calcular el número de moles son los de antes.
Recuerda que siempre tenemos que poner en la fórmula las unidades en gramos, excepto para el número de moles que la unidad es moles.
Sabiendo y entendiendo esto podrás calcular los moles de cualquier sustancia (átomo, molécula, etc.…).
Ejercicio 2
¿Cuántos moles están presentes en 25 g de carbonato de calcio?
Lo primero tendremos que sabe la fórmula del carbonato cálcico que es CaCO3.
– Ca número atómico = 40
– C número atómico = 12
– O número atómico = 16 pero como son 3 átomos serán 48.
Sumando todo tenemos la masa molecular del carbonato cálcico = 40 + 12 + 48 = 100 gramos.
Ahora solo tenemos que aplicar la fórmula:
Numero de Moles = Masa total / Masa molecular = 25 / 100 = 0, 25 moles.
¿A que es Fácil?
Vamos a hacer otro ejemplo para que nos quede claro.
Ejercicio 3
Queremos calcular cuántos moles de CO2 (dióxido de carbono) hay en 200 gramos de CO2:
Los datos que tenemos que saber son que la masa molecular en gramos del CO2 es 44 gr.
Entonces tendremos:
Así podemos decir que 200 gramos de CO2 son 4,54 moles de CO2.
Si quisiéramos calcularlo a la inversa sería muy fácil, es decir, si queremos saber cuántos gramos contienen 4,54 moles de CO2:
El número de Avogadro (NA = 6,022 x 1023 moléculas o átomos) nos servirá siempre para calcular el número de moléculas de una sustancia.
Es decir, si queremos saber cuántas moléculas de CO2 hay en 200 gramos de CO2 o lo que es lo mismo en 4,54 moles de CO2 tendríamos:
Tienes más ejercicios en el siguiente enlace: Ejercicios de Moles
Espero que ahora te resulte mucho más fácil calcular y hacer problemas de numero de moles, algo que parece difícil pero que como ves es muy sencillo.
Si te ha gustado la web Mol pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.
Cuantas moléculas de sustancia están contenidas en: 7.8 moles de ácido Sulfúrico (H2SO4)
Por favor me pueden ayudar con esto?!! Lo necesito para mañana :,(
No resolvemos problemas ni deberes. Si lees la página lo aprenderás hacer ya que es muy fácil
Excelentes los ejemplos y los modelos de resoluciones. Necesito apoyo en funciones oxidación y reducción. Convesiones de moles, a mi correo.
oh si perdón
Cuantos números de moleculas hay en 547 L de H2O (pagua = 1g/ml)
Me dejaron esta tarea (no quiero que me den la respuesta) por lo que leí y entendí tengo que pasar 547 L a ml para multiplicarlo con el peso del agua se cancele ml y me quede g?
Me ayudan con unos ejercicios por favor el número de moles de 0’2mol KI 1.5mol H2SO4 0.9mol HNO3 2mol CH4
No resolvemos ejercicios. Un saludo
Muy bien explicado
Hay un error, en el ejercicio se muestran los números atómicos de distintos elementos, y realmente ese número es la masa atómica. El número atómico del oxígeno es 8, es su masa lo que es 16.
¿De qué ejercicio dices que hay un error? La masa atómica del O efectivamente es 16 pero creo que es lo que pone.
Un saludo
pues me a parecido perfecta la explicación aunque no entendí muy bien el ejercicio 3