Los Óxidos de Cloro son compuestos químicos formados por átomos de Cloro y Oxígeno.
Cloro + Oxígeno = Óxidos de Cloro
El Cloro tiene valencias posibles las siguientes: I, III, V y VII
El Oxigeno siempre tiene valencia II
Indice de Contenidos
Fórmulas de los Óxidos de Cloro
Hay varios óxidos de cloro, exactamente 11, pero solo 4 de estos óxidos de cloro son importantes para la química:
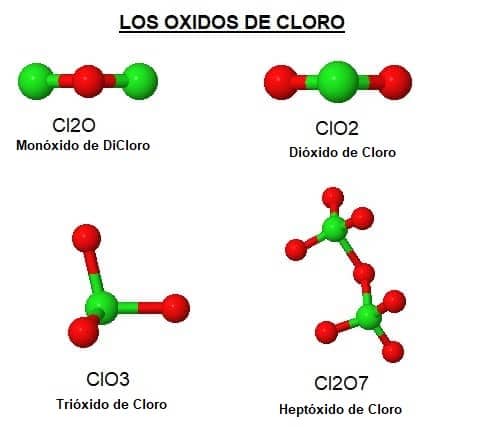
– Cl2O = Monóxido de DiCloro o Monóxido de Cloro (I) o Anhídrido Hipocloroso
– ClO2 = Dióxido de Cloro u Óxido de Cloro (II)
– ClO3 = Trióxido de Cloro u Óxido de Cloro (III)
– Cl2O7 = Heptaóxido de Dicloro u Óxido Perclórico, también llamado óxido de cloro (VII), Anhidrido perclórico, Hetaóxido de Cloro u Óxido de Cloro (VII)
Moléculas de los Óxidos de Cloro
Características de los Óxidos de Cloro
En presencia de materia oxidable, los óxidos de cloro tienden a explotar.
Dióxido de Cloro
El dióxido de cloro es un oxidante fuerte que se agrega al agua para desinfectar y eliminar el sabor y el olor.
El dióxido de cloro se descompone rápidamente en clorito, cloruro y clorato.
No está presente de forma natural en la naturaleza, se elabora sintéticamente.
Se utiliza como blanqueador en plantas papeleras y como desinfectante de agua.
Debido a su alta reactividad, el dióxido de cloro emitido no persiste mucho tiempo como tal en el medio ambiente.
El dióxido de cloro es un compuesto inestable que debe prepararse en solución en el lugar de su uso.
A temperatura estándar es un gas amarillo rojizo con una masa molar de 67,46 g / mol.
Se obtiene por oxidación de una solución de clorito de sodio, utilizando cloro o ácido clorhídrico.
Estequiométricamente, para producir 1 g de CℓO 2 , se necesitan 1,34 g de clorito de sodio y 0,526 g de cloro.
A temperatura ambiente, el dióxido de cloro es un gas de olor acre de color ámbar con un olor similar al cloro.
Las mezclas de aire y dióxido de cloro pueden explotar muy fácilmente y descomponerse en cloro y oxígeno.
La solución acuosa, por otro lado, no es explosiva.
El punto de ebullición del dióxido de cloro es de 11 ºC, por lo que se vuelve líquido en el frigorífico.
La molécula de dióxido de cloro es un radical, en el átomo de cloro hay una nube esférica que está ocupada por un solo electrón.
Por cierto, la estructura de la molécula de dióxido de cloro no se puede describir con el modelo de nube esférica, ya que el átomo de cloro forma dos enlaces covalentes con cada átomo de oxígeno y luego tiene un par de electrones libres y el radical electrón «solitario».
En consecuencia, el cloro tiene 11 electrones de valencia si se cuentan los electrones de los cuatro enlaces covalentes por completo, como es realmente normal.
Monóxido de Dicloro
El Cl2O, es de un color amarillo-marrón y un gas con un penetrante olor parecido a la olor de cloro.
Se tiene un punto de fusión punto de -121 ° C y un punto de ebullición punto de 2 ° C.
Es un vigoroso agente oxidante e inestable compuesto, que lentamente se descompone en condiciones normales y puede explotar espontáneamente en forma concentrada y condensada : 2Cl 2 O = 2Cl 2 + O 2 .
Es fácilmente soluble en agua (aproximadamente 200 volúmenes de Cl2O se disuelven en un volumen de agua) y de carbono tetracloruro.
Al disolverse en agua, se produce hipocloroso ácido, HCIO.
El Monóxido de DiCloro puede ser producido por la reacción de cloro con recién precipitado seco mercúrico óxido:
2HgO + 2Cl 2 = HgCl 2 + Cl 2 O
En la industria, se producen soluciones acuosas que están producidas por la cloración de carbonatos de álcali o metales alcalinotérreos en agua.
Se utiliza en la producción de hipoclorito de calcio .
Monóxido de Cloro
El monóxido de cloro ClO también es un radical; sin embargo, aquí el electrón «solitario» no se encuentra en el átomo de cloro, sino en el átomo de oxígeno.
El ClO se forma, entre otras cosas, por la descomposición térmica del dióxido de cloro, por fotólisis de mezclas de oxígeno-cloro o por la reacción de radicales de cloro con dióxido de cloro u ozono.
El monóxido de cloro se forma en la atmósfera terrestre a través de la siguiente reacción:
Los radicales de cloro se liberan mediante la reacción de los CFC (clorofluorocarbonos) liberados con oxígeno.
Cl + O 3 → ClO + O 2
La reacción anterior ataca la capa de ozono de la tierra (-> agujero de ozono ), lo cual es muy perjudicial porque esta capa de ozono nos protege de la radiación ultravioleta (UV) no deseada.
Si te ha gustado pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.