Gracias a la tensión superficial, el agua forma una “piel” en la superficie sobre la que, por ejemplo, pueden caminar algunos insectos.
Indice de Contenidos
¿Qué es la Tensión Superficial?
La tensión superficial es una propiedad de la superficie (interfaz) que hay entre un líquido y un gas como por ejemplo el aire.
En este caso la «Superficie» o «Interfaz» es el límite entre el agua y el aire.
Es el fenómeno físico que se produce en la superficie de los líquidos debido a las fuerzas moleculares del líquido, y que hace que la superficie se haga lo más pequeña posible.
La superficie se comporta como una piel tensa, aparentemente elástica.
Cuanto mayor es el valor de la tensión superficial, más tensa parece estar esta piel .
Este efecto es lo que hace que el agua forme gotitas, por ejemplo, y contribuye al hecho de que algunos insectos puedan caminar sobre el agua o que una moneda «flote» en el agua.
La tensión superficial (símbolo de fórmula: σ , γ ) a veces también se conoce como la tensión interfacial que actúa en la interfaz de dos sustancias en cualquier fase.
Se mide en las unidades SI kg/ s² , equivalente a N / m .
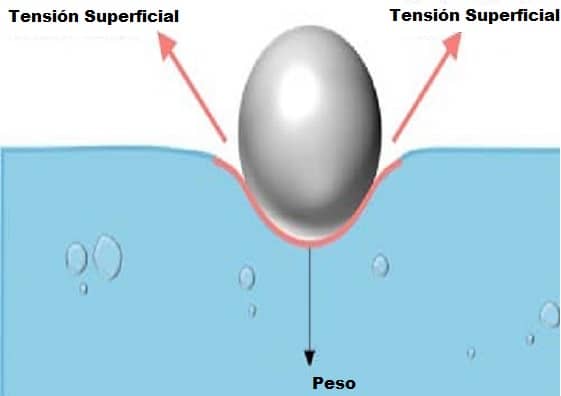
Como ya dijimos, la tensión superficial ayuda a algunos insectos, como los zancudos de agua, a caminar sobre la superficie del agua, pero OJO, si el insecto atravesara la superficie en algún momento, se hundiría.
También puedes colocar objetos ligeros y planos, como hojas de afeitar o un trozo de papel de aluminio , sobre una superficie de agua sin hundirlos.
Pero una vez que se sumergen lo suficiente, se hunden hasta el fondo.
Explicación Física
Las fuerzas de atracción y repulsión actúan sobre las moléculas dentro de un líquido.
El agua está formada por pequeñas partículas llamadas moléculas de agua.
Estas moléculas tienen áreas ligeramente cargadas positivamente y ligeramente cargadas negativamente.
Se dice que tienen carácter dipolar, 2 polos el + y el -.
Lo positivo y lo negativo se atraen, mientras que lo positivo y lo positivo se repelen (al igual que lo negativo y lo negativo).
Por lo tanto, las moléculas de agua siempre se organizan en un cierto patrón y se mantienen juntas gracias a estas fuerzas (fuerzas cohesivas intermoleculares).
Cohesivas = de unión
Cohesionados = Unidos
Resumiendo: debido a su carácter dipolar, las moléculas de agua se atraen entre sí y forman enlaces de hidrógeno.
Cuando una de estas moléculas está en el interior de un líquido, experimenta interacciones con otras moléculas desde todos los lados, pero cuando las moléculas están en la superficie solo se ven afectadas (cohesionadas) por las moléculas que tiene al lado y las moléculas que están en la capa debajo de ellas.
Las moléculas que ves en la imagen en la superficie están más unidas, con mayor fuerza que las del interior del líquido.
Las del interior del líquido al tener fuerzas hacia arriba y hacia abajo, el resultado de la suma de todas las fuerzas, que sería la fuerza que las mantiene unidas, están menos, y por lo tanto están menos unidas (tienen menos fuerza de cohesión).
En la imagen siguiente puedes ver la figura A dentro del agua y cómo todas las moléculas están en equilibrio gracias a la fuerza intermolecular de cohesión.
Pero esta simetría ya no se da en la interfaz entre líquido y gas.
En la superficie del agua hay moléculas de agua.
Por su parte superior hay aire y no hay fuerzas de atracción molecular entre las moléculas de agua y del aire (fluido diferente).
Pero por su parte inferior y lateral tienen moléculas de agua, por lo tanto, por esa parte tienen fuerzas de atracción, que como resultado es la fuerza total F representada en la imagen anterior.
Por la parte superior de estas moléculas no existe esa fuerza F de atracción que hay por la parte de abajo.
Esto significa que las moléculas en la interfaz solo tienen una fuerza resultante dentro del líquido.
Estas partículas o moléculas de la superficie se aferran (unen) a las partículas de agua vecinas y las partículas de agua por debajo de ellas con mayor intensidad.
Esta fuerza, hace que la superficie del agua se encoja tanto como sea posible y de alguna manera también se tense -> tensión superficial.
Si deseas mover una molécula de líquido desde el interior del líquido hasta la superficie, debes vencer esa fuerza F.
Como la fuerza solo es solo hacia un lado (al interior), esto da como resultado la llamada «tensión superficial del agua«.
Por lo tanto, una molécula en la superficie tiene una energía mayor que una molécula dentro del líquido.
Cálculo y Fórmula de la Tensión Superficial
La fórmula general para medir la tensión superficial es gamma es igual a la fuerza dividida por la longitud.
Para calcularla se hace el siguiente experimento:
Se crea una película de líquido, normalmente agua con jabón, y se estira sobre un marco a través de un alambre que se puede deslizar por el marco.
Al marco de alambre tiene un ancho «h»
Se desliza la película de agua con jabón una longitud que llamamos Δ s
Y para ese movimiento utilizamos una fuerza que llamaremos F
La película de agua con jabón se estira de una superficie inicial A hasta alcanzar otro superficie mayor llamado A´
Δ A es el incremento la resta de la superficie final A´ de la superficie inicial A.
Superficie inicial = h x s
Superficie final =
Δ A = h x (s + Δs) – (h x s) = (h x s + h x Δs) – (h x s) = h x Δs
Pero OJO la superficie aumentó en los dos lados de la capa, ya que se forma una nueva superficie en los 2 lados frontal y posterior por lo que el incremento real de superficie será:
Δ A = 2 Δ s h
Para mover el soporte la distancia Δs contra la fuerza F , se debe realizar trabajo:
Recuerda que Trabajo = Fuerza x distancia, es decir, en nuestro caso
W = F ·Δ s
Cómo la tensión superficial es el trabajo realizado entre la superficie producida, tenemos que, después de dividir por Δ A obtenemos:
W o / Δ A = F / (2 · h) = γ
Gamma «γ» representa la tensión superficial, F representa la fuerza y h representa la longitud a lo largo de la cual se siente la fuerza.
El cociente «trabajo realizado por superficie producida», o lo que es lo mismo, la tensión superficial del líquido es una constante: γ
Por lo tanto, la unidad es W/A => J/m 2 = N · m/m 2 = N/m o mN/m y, por lo tanto, también puede llamarse energía superficial.
Las unidades de tensión superficial son Newton por metro (N/m) o dina por centímetro (dyn/cm).
A veces, en lugar de h verás en la fórmula la letra b o B, pero es lo mismo, representa él ancho de la lámina que estiramos de agua con jabón.
La tensión superficial depende de la naturaleza del líquido, del medio que le rodea y de la temperatura.
Una cosa muy importante a tener en cuenta es que a medida que aumenta la temperatura, la tensión superficial del agua disminuye.
Esta es la razón por la que el agua caliente es mucho mejor para lavar la ropa que el agua fría.
La menor tensión superficial del agua caliente le permite interactuar con la suciedad de la ropa más que el agua fría.
Como se indicó anteriormente, la alta tensión superficial del agua se debe a los dipolos que se encuentran en las moléculas de agua.
Esta interacción dipolar disminuye a medida que aumenta la temperatura porque las moléculas se mueven más rápido.
Tensiones Superficiales de algunos Líquidos
Importancia de la Tensión Superficial
Los efectos de la tensión superficial son de importancia central en muchos fenómenos cotidianos: hace que pequeñas gotas de lluvia se adhieran a las ventanas, crea burbujas cuando agrega detergente en el fregadero y empuja a los insectos que se desplazan por el agua a la superficie de los estanques.
Pero también determina el comportamiento de los líquidos en una variedad de procesos y fenómenos.
Los jabones y detergentes ayudan a la limpieza al reducir la tensión superficial del agua para que pueda penetrar más fácilmente en los poros y las áreas sucias.
Calentar el agua implica que se hace disminuir su tensión superficial, lo que puede mejorar la eficiencia del agua en la limpieza.
Aunque la tensión superficial del agua puede reducirse significativamente con jabones y detergentes, calentar el agua también puede ser la solución.
Uso de desinfectantes : los desinfectantes se esparcen en las paredes celulares de las bacterias y las alteran. Para ello son necesarias soluciones de baja tensión superficial.
Las gotas de líquido adquieren su forma debido a la tensión superficial.
Las gotas de agua se juntan debido a sus fuerzas de atracción y, debido a la tensión superficial, toman la forma esférica para tener la menor área posible.
Humectabilidad y humectabilidad : La humectación (que se moje) de un sólido por un líquido depende, entre otras cosas, de la tensión superficial.
Esto juega un papel importante en el lavado y la limpieza, pero también en los procesos de humectación, como la impresión o el recubrimiento.
Tamaño de gota: En un spray o una emulsión , cuanto mayor sea el área de superficie total de las gotas, más pequeñas serán las gotas individuales.
Por lo tanto, el tamaño de las gotas generadas depende de la tensión superficial.
Dispersiones y dispersabilidad: la dispersión crea interfaces entre las partículas sólidas y el líquido.
Una tensión superficial alta tiene un efecto negativo sobre la dispersabilidad, ya que se prefiere el contacto entre partículas del mismo tipo (formación de grumos).
La tensión superficial está involucrada en el proceso de digestión ; porque las sales biliares reducen la tensión superficial de los lípidos y así ayudan a la emulsificación.
Como resultado, aumenta el área superficial lo que favorece la actividad de la lipasa sobre los lípidos.
Si te ha gustado la página sobre Tensión Superficial pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.
Como puedo citar en apa su pagina?
?
Por la webgrafia con la Dirección de la Página. Un saludo
Al fin lo entendiii, graciasgraciasgracias