El número de oxidación se define como la carga, ya sea positiva o negativa, que gana un átomo de un elemento cuando forma enlaces con átomos de otros elementos, ya sea compartiendo o transfiriendo electrones.
Nos indica cuántas cargas elementales ha absorbido o liberado formalmente un átomo cuando se encuentra formando un compuesto.
Los elementos tienen un estado de oxidación cero y el estado de oxidación de un átomo es igual al número de electrones que se han eliminado de un elemento (produciendo un estado de oxidación positivo) o agregados a un elemento (produciendo un estado de oxidación negativo).
La transferencia de electrones de un átomo a otro se refleja en que el número de oxidación de uno (que pierde electrones) aumenta y el del otro (que acepta electrones) disminuye.
Un número de oxidación positivo indica que la densidad de electrones se reduce de su estado normal, un número de oxidación negativo indica que la densidad de electrones alrededor del átomo aumenta.
La carga que aparece como número de oxidación es básicamente la cantidad de electrones que pierde, gana o comparte el átomo durante la formación de un enlace con átomos de otro elemento en una molécula.
El número de oxidación generalmente se asigna a los átomos en la reacción en la que sufren oxidación y reducción (redox).
Una reacción de este tipo en la que los átomos se oxidan o se reducen se denomina reacción redox.
La palabra redox es un acrónimo de dos palabras reducción y oxidación.
Por eso también usamos el número de oxidación de un átomo en un compuesto químico formalmente como una medida que indica las relaciones de densidad de electrones alrededor de este átomo.
Se utiliza en las reacciones químicas para reconocer mejor los procesos, y a menudo, sólo determinando los números de oxidación de los átomos individuales queda claro qué reacción química está teniendo lugar.
Lógicamente un mismo elemento, según el compuesto del que forma parte, puede tener varios números de oxidación .
Los números de oxidación son un modelo que ayuda a saber si el átomo en cuestión está más o menos unido con otros átomos
Los números de oxidación en los compuestos se escriben en números romanos encima de los símbolos de los átomos
Indice de Contenidos
Determinación del Número de Oxidación
Un método para calcular el número de oxidación es el siguiente:
El número de oxidación de un átomo es el número de electrones perdidos o ganados para formar enlaces con heteroátomos en una molécula particular.
La molécula puede ser neutra, es decir, su carga total es cero o puede estar cargada, es decir, tiene alguna carga general positiva o negativa.
Para encontrar el número de oxidación de un átomo debemos seguir los siguientes pasos:
Paso 1: Suponga que el número de oxidación del átomo es X y debe calcularlo.
Paso 2: Mencione el estado de oxidación de otros átomos unidos y multiplíquelo por el número de dichos átomos presentes en una molécula.
Paso 3: Escribe el número de oxidación de todos los átomos de la molécula en un formato de suma lineal y equiparalo con la carga total de la molécula.
Paso 4: Resuelva para X.
El cálculo del número de oxidación se puede entender con los siguientes ejemplos.
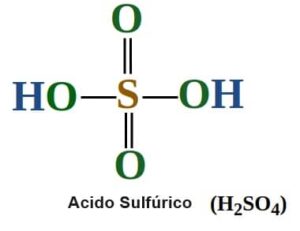
Ejemplo 1: Calcular el número de oxidación del azufre en H 2 SO 4
Solución:
Paso 1: Suponga que el número de oxidación del azufre es x
Paso 2: El número de oxidación del hidrógeno es +1 y del O es -2.
Paso 3: Dado que la carga total de la molécula es 0, entonces 2(+1) + X + 4(-2) = 0
Paso 4: 2 + X – 8 = 0 ⇒ X – 6 = 0 ⇒ X = +6
Por lo tanto, el número de oxidación del azufre en H 2 SO 4 es +6
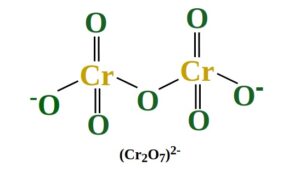
Ejemplo 2: Calcular el número de oxidación del cromo en Cr 2 O 7 2-
Solución:
Paso 1: Suponga que el número de oxidación del cromo es X
Paso 2: el número de oxidación del oxígeno es -2
Paso 3: Dado que la molécula tiene una carga total de -2, la ecuación se puede escribir como 2X + 7(-2)=-2
Paso 4: 2X – 14 = -2 ⇒ 2X = +12 ⇒ X = +6
Por tanto, el número de oxidación del cromo en Cr 2 O 7 2- es +6.
Cabe señalar que en una molécula pueden existir diferentes números de oxidación para un mismo átomo. Esto se puede entender en el siguiente ejemplo.
Cálculo de números de oxidación múltiple de un átomo en una molécula.
Ejemplo: Calcule el número de oxidación del nitrógeno en nitrato de amonio, es decir, NH 4 NO 3
Solución:
Paso 1: En este caso, dividiremos la molécula en dos iones: ion amonio (NH 4 + ) y ion nitrato (NO 3 – ).
Paso 2: Encontraremos el número de oxidación del Nitrógeno en cada ion. Suponga que el número de oxidación del nitrógeno es X en cada caso.
Paso 3: Para el ion amonio, dado que la molécula tiene una carga total +1, la ecuación se puede escribir como X + 4(+1) = +1
Paso 4: Resolver la ecuación X + 4 = 1 ⇒ X = -3
Paso 5: En el caso del ion nitrato, el número de oxidación del oxígeno es -2 y la molécula tiene una carga total de -1.
Paso 6: Por lo tanto, la ecuación, en este caso, será X + 3(-2) = -1
Paso 7: Resolviendo la ecuación obtenemos X – 6 = -1 ⇒ X = +5
Por tanto, el número de oxidación del nitrógeno en el nitrato de amonio es -3 y +5.
En los ejemplos anteriores, vimos que algunos átomos tienen números de oxidación fijos.
Más adelante veremos más ejemplos de cómo se obtiene el número de oxidación, pero aquí te dejamos algunos p ara ir abriendo boca:
Para comprender por qué algunos átomos tienen números atómicos fijos, debemos observar las reglas del número de oxidación que se mencionan a continuación.
Reglas para asignar números de oxidación
Existen las siguientes reglas para asignar números de oxidación constantes a los átomos de un elemento.
Regla 1: El total de todos los átomos en los números de oxidación de una molécula es igual a cero.
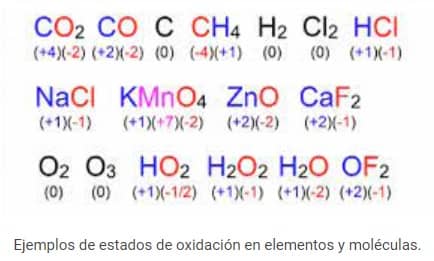
Por ejemplo , en KMnO 4 , el número de oxidación de K es +1, el número de oxidación de Mn es +7 y el número de oxidación del oxígeno es −2.
Regla 2: el número de oxidación de un átomo es siempre 0 en su forma más básica.
Por ejemplo, el número de oxidación de H, O, N, P, S, Se, Cu, Ag en sus formas elementales es H 2 , O 2 , N 2 , P 4 , S 8 , Se 8 , Cu, Ag respectivamente, es cero. .
Regla 3: Los metales alcalinos (Li, Na, K, Rb, Cs) tienen un número de oxidación de +1 en sus compuestos.
por ejemplo , en NaCl, el número de oxidación del Na es +1.
Regla 4: Los metales alcalinotérreos (Be, Mg, Ca, Sr, Ba) suelen tener un número de oxidación +2 en sus compuestos.
por ejemplo, el número de oxidación del Mg en MgO es +2.
Regla 5: Excepto en los hidruros metálicos, el número de oxidación del H en su compuesto es siempre +1.
por ejemplo , en HCl, el número de oxidación de H es +1 y en NaH (hidruro de sodio), el número de oxidación de H es −1.
Regla 6: El número de oxidación del flúor es 1 en todos sus compuestos.
por ejemplo , en NaF, el número de oxidación de F es −1.
Regla 7: La carga de un compuesto iónico es igual a la suma de todos los estados de oxidación de todos los átomos del compuesto.
por ejemplo, en SO 4 2- el número de oxidación del azufre es +6. El número de oxidación del oxígeno es −2. Por tanto, la suma es +6+4(-2) = 6-8 = -2.
Regla 8: Excepto el oxígeno y el flúor, el número de oxidación máximo de cualquier elemento es igual a su número de grupo.
Por ejemplo, el número de oxidación del azufre en H 2 S 2 O 8 , K 2 S 2 O 8 , S 2 O –2 8 y H 2 SO 5 es +6 debido a la presencia de un enlace peróxido.
Regla 9: Es posible que no todos los átomos de un mismo elemento tengan el mismo número de oxidación en determinados compuestos. Obtenemos el resultado promedio cuando calculamos el número de oxidación de ese elemento en dichos componentes.
Por ejemplo , un átomo de azufre en Na 2 S 2 O 3 tiene un número de oxidación de +6, mientras que los otros átomos de azufre tienen un número de oxidación de -2. Como resultado, el número promedio del estado de oxidación del azufre en Na 2 S 2 O 3 es +2.
Estructura del tiosulfato de sodio.
Regla 10: El carbono en las moléculas orgánicas puede tener cualquier número de oxidación entre -4 y +4.
por ejemplo , en HCHO, el número de oxidación del carbono es cero.
Regla 11: El número de oxidación común de un elemento es equivalente a su número de grupo de IA a IV A. La fórmula (Número de grupo –8) da el número de oxidación común de cualquier elemento de VA a VIII-A.
Por ejemplo:
Número de oxidación de elementos del grupo IA = +1.
Número de oxidación de los elementos del grupo II A = +2.
Número de oxidación de los elementos del grupo III A = +3.
Número de oxidación de los elementos del grupo IV A = +4.
Número de oxidación de elementos del grupo VA = –3.
Número de oxidación de los elementos del grupo VI A = –2.
Número de oxidación de los elementos del grupo VII A = –1.
Número de oxidación de los elementos del grupo VIII A = 0.
Regla 12: C, N, P y S tienen números de oxidación de 4, –3, –3 y –2 en todos los carburos, nitruros, fosfuros y sulfuros, respectivamente.
por ejemplo, en Mg 3 N 2 , el número de oxidación del nitrógeno es −3.
Regla 13: En todos los carbonilos metálicos, el número de oxidación de los metales es cero.
por ejemplo, en Ni(CO) 4 , el número de oxidación del Ni es cero.
Regla 14: Excepto el peróxido, superóxidos, oxifluoruros y ozónuros, el oxígeno tiene un número de oxidación de -2 en la mayoría de sus óxidos.
por ejemplo, en Na 2 O, el número de oxidación del O es −2.
Casos excepcionales de número de oxidación del oxígeno.
Peróxidos: El número de oxidación del oxígeno en los peróxidos es 1. Algunos ejemplos son H 2 O 2 y Na 2 O 2 .
El número de oxidación del oxígeno en los compuestos de flúor es +2. Algunos ejemplos son F 2 O o OF 2 , etc.
Superóxidos: El número de oxidación del oxígeno en los superóxidos es –1/2.
Ozonuros: Cada átomo de oxígeno en un ozonuro tiene un número de oxidación de –1/3.
Ejemplos de Calculo del Número de Oxidación
Número de oxidación del manganeso en KMnO 4
Solución:
Sea el número de oxidación del manganeso en KMnO 4 igual a X
El número de oxidación del potasio = +1
El número de oxidación del oxígeno es = –2.
⇒1 + (X) + 4×(–2)=0
⇒1 + X – 8 = 0
⇒X -7 = 0
⇒X = +7
El número de oxidación del manganeso en KMnO 4 es +7.
Número de oxidación del carbono en Na 2 CO 3
Solución:
El número de oxidación del oxígeno es = –2
Número de oxidación del sodio = +1
Sea X el número de oxidación del carbono.
⇒2(+1) + X + 3(–2) = 0
⇒2 + X – 6 = 0
⇒X – 4 = 0
⇒X = +4
Por lo tanto X = +4
El número de oxidación del carbono en Na 2 CO 3 es +4
Número de oxidación del nitrógeno en el nitrito de amonio
Solución:
El nitrito de amonio es un compuesto iónico que contiene iones NH 4 + y NO 2 – .
Número de oxidación del nitrógeno en NH 4 +.
Sea x el número de oxidación del átomo de N
⇒ x + 4 = +1
⇒ x = 1 – 4 = -3
Número de oxidación del nitrógeno en NO 2 –
Sea Y el número de oxidación del átomo de nitrógeno.
Y + 2(-2) = -1
⇒ Y – 4 = -1
⇒ Y = -1 + 4 = +3
Por lo tanto, un átomo de nitrógeno en el nitrito de amonio está en el estado de oxidación -3, mientras que el otro átomo de nitrógeno está en el estado de oxidación +3.
Número de oxidación del carbono en CN –
Solución:
Sea x el número de oxidación del átomo de C en CN , el número de oxidación del átomo de N es -3 y la carga total de la molécula es -1.
⇒ x – 3 = -1
⇒ x = -1 + 3 = +2
Por lo tanto, el átomo de carbono tiene un número de oxidación de +2 en CN –
Número de oxidación del N en NH 3
Solución:
Sea x el número de oxidación de N en NH 3 y sabemos que el número de oxidación de H es +1.
⇒ x + 3(+1) = 0
⇒ x + 3 = 0
⇒ x = -3
Por tanto, el número de oxidación del átomo de N en NH 3 es -3.
Si te ha gustado Número de Oxidación pulsa en Compartir. Gracias

Buen día! Esta muy bueno el documento. Pero en la primera imagen, donde aparecen varios compuestos con sus estados de oxidación, el del amoníaco está mal, dice +3 para el N y -1 para el H. Después, más abajo en el texto está explicado bien.
calcula el número del oxidación del magnesio en el en el pernagato de potasio