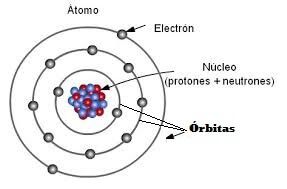
Antes de ver los enlaces iónicos tenemos que recordar que los átomos están formados por protones, neutrones y electrones.
Estos últimos, los electrones, tienen carga negativa y son los que entran en juego en los enlaces de los átomos, por lo tanto son los únicos que nos interesan.
Estos electrones se encuentran dentro del átomo girando en órbitas alrededor de su núcleo.
Estas órbitas se llaman orbitales, capas o niveles de energía.
Indice de Contenidos
¿Cómo se Unen los Átomos?
Los enlaces químicos son las fuerzas que mantienen unidos a los átomos.
Una de las formas de unión es formando enlaces iónicos que son los que explicaremos aquí.
Cuando dos átomos se unen pueden ceder, aceptar o compartir electrones entre ellos.
Pero OJO, solo los llamados electrones de valencia pueden hacer alguna de estas cosas.
La pregunta entonces será….
¿Cuáles son los electrones de valencia?
Los electrones de valencia son los que se encuentran en la última capa del átomo y como ya vimos, son los únicos que están dispuestos a ser compartidos o cedidos a otro átomo para formar un enlace.
Ahora que ya tenemos claro que partículas unen a los átomos, veamos de qué forma se unen.
Cuando dos átomos se unen siempre cumplen la llamada regla del octeto.
Regla del Octeto
La regla del octeto, también llamada ley de Lewis dice que todos los átomos de los elementos del sistema periódico tienden a completar sus últimos niveles de energía con una cantidad de 8 electrones.
Es decir, serán los electrones de la última capa, los más alejados del núcleo, los que tienden a completarse hasta ser un total de 8 electrones y para ello compartirán electrones con otro átomo si fuera necesario, hasta llegar a 8.
Los gases nobles son los únicos no reactivos, o lo que es lo mismo, los únicos que no hacen enlaces con otro átomos porque ya tienen 8 electrones en su última capa y no admiten más.
Esta combinación o unión de varios átomos se puede hacer de varias formas, una de ellas es el enlace iónico.
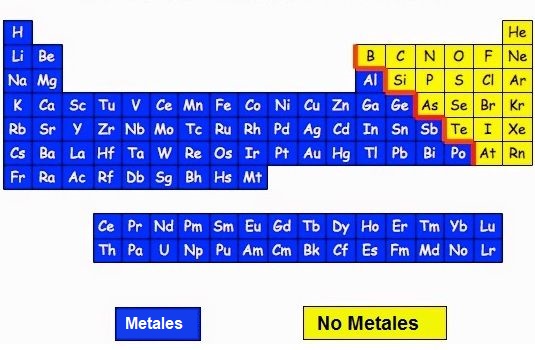
Metales y No Metales
Muy Importante: «Los enlaces iónicos están formados por un Metal más un No metal«.
Cationes y Aniones
Antes de seguir, explicaremos que son los cationes y lo aniones, muy importante para entender los enlaces iónicos.
Los electrones y los protones de un átomo tienen la misma cantidad de carga eléctrica, pero los electrones negativa y los protones positiva.
Los átomos tienen carga neutra (sin carga) ya que tienen tantos electrones con carga negativa, como protones con carga positiva, por lo que se anula la negativa de los electrones con la positiva de los protones.
Pero si a un átomo le quitamos un electrón, lógicamente quedará con carga positiva (tiene 1 protón más que el número de electrones).
Si le añadimos un electrón quedará con carga negativa.
Según lo dicho tenemos:
Cationes: átomos con carga positiva y se forman cuando ceden un electrón suyo a otro átomo (pierden un electrón).
Aniones: átomos con carga negativa, ya que cogen un electrón de otro átomo (aumentan en un electrón).
Para saber más visita: Iones
Los Enlaces Iónicos
Sigamos con los enlaces iónicos formados por Metal + No metal = enlaces iónicos.
Ten siempre en cuenta los siguiente:
«Los metales ceden electrones formando cationes, los no metales aceptan electrones formando aniones«.
Recuerda que una carga eléctrica negativa y otra positiva se atraen.
¿Qué pasará con el catión (carga positiva) y el anión (carga negativa) formado por los dos átomos al encontrarse?
Pues que se atraen y forman el enlace iónico.
Una vez hecho el enlace, este no forma moléculas verdaderas, los átomos solo están unidos por fuerzas eléctricas.
El resultado son Iones positivos y negativos que se atraen entre sí, llamados enlaces iónicos, pero no moléculas verdaderas.
En los enlaces covalentes si se forman moléculas, pero no es el tema que tratamos aquí.
Ejemplos de Enlaces Iónicos
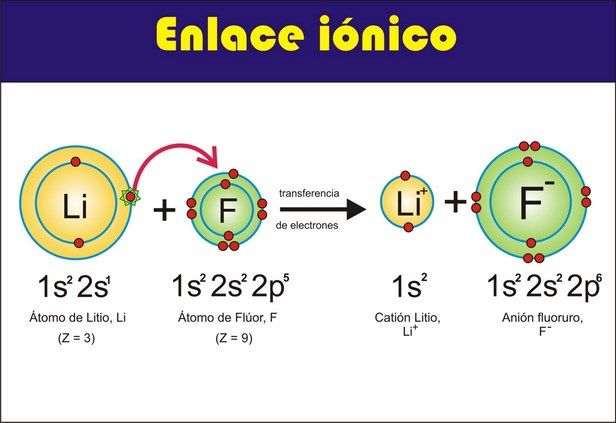
Veamos un primer ejemplo:
Fíjate el Li (litio) tiene en su última capa (capa S) un electrón, el F (Flúor) tiene en su última capa (capa p) 5 electrones.
Se unen mediante un enlace iónico cediendo el litio el único electrón de su última capa al flúor, con lo que el flúor tiene ahora 6 átomos en su última capa (más cerca de los 8 ideales).
Más abajo tienes un enlace para saber los electrones en cada capa llamado configuración electrónica.
El Litio es el metal, cede un electrón y se convierte en un catión.
El Flúor es el No Metal, coge un electrón y se convierte en un anión.
Los dos ahora quedan unidos por la fuerza eléctrica, una positiva (la del catión) y otra negativa (la del anión), formando un enlace iónico.
Veamos ahora el caso del cloruro sódico, la sal común.
El sodio (Na) cede un electrón, y el cloro (Cl) lo coge.
Se expresa de la siguiente fórmula:
Na – 1 e- —> Na+ (un catión de sodio)
Cl + 1 e- —> Cl- (un anión de cloro)
Lógicamente para saber hacer enlaces iónicos hay que saber el número de electrones que tiene cada átomo en su última capa, a esto se le llama la configuración electrónica de cada elemento, que no es ni mas ni menos como se distribuyen los electrones en las diferentes órbitas del átomo.
Eso lo puedes aprender aquí: Configuraciones electrónicas.
Como ves si sabemos la configuración electrónica de los elementos de la tabla periódica, es muy fácil hacer sus enlaces iónicos.
Más enlaces iónicos son estos:
NaCl (cloruro de sodio),
KCl (cloruro de sodio),
KI (ioduro de potasio),
CaCl2 (cloruro de calcio),
FeO (óxido de hierro (II)),
MnO2 (manganesa),
Li3N (nitruro de litio),
CaC2 (acetiluro de calcio),
Ca3P2 (fosfuro de calcio) y
AgCl (cloruro de plata).
Si te ha gustado enlace iónico pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.
¿Cómo hago con un Zr y dos O?
ZrO2
COMO HAGO EL ENLACE IONICO DE OXIGENO CON CALCIO
Lee la página y ya verás como es muy facil
Porque en algunos compuestos se les escribe el átomo y en otros no?