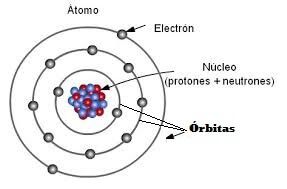
Sabemos que un átomo es eléctricamente neutro, es decir que hay tantas cargas positivas (protones) como cargas negativas (electrones).
Los electrones, con carga eléctrica negativa, están girando alrededor del núcleo del átomo en lo que se llaman órbitas, y los protones, con carga positiva están en el núcleo, junto con los neutrones que no tienen ni carga positiva ni negativa, es decir son eléctricamente neutros.
La carga eléctrica de un electrón es igual a la carga eléctrica de un protón pero de sentido contrario, por lo que el átomo será eléctricamente neutro ya que hay igualdad entre las cargas + y las –.
Para saber más sobre el átomo visita: Descubrimiento del Atomo.
Indice de Contenidos
¿Qué es un Ion?
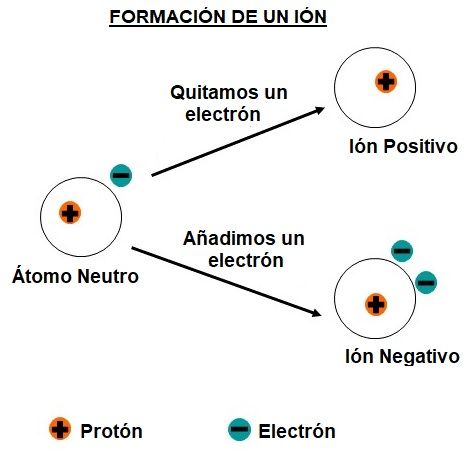
Cuando las órbitas de un átomo ganan o pierden electrones, el átomo forma lo que se conoce con el nombre de un ion.
Si pierde un electrón => Ion Positivo (Catión)
Si Gana un electrón => Ion Negativo (Anión)
Un ion es un átomo que ha perdido o ganado uno o más electrones.
Un átomo solo puede perder o ganar electrones (cargas negativas), por lo que la cantidad de protones (cargas positivas) no cambia.
Al perder uno o más electrones, el ion quedará cargado positivamente, ya no habrá igualdad entre las cargas positivas y negativas, los electrones estarán en déficit, habrá más protones con carga positiva.
Por contra, al ganar uno o más electrones, el ion se cargará negativamente.
Conclusión: Un ion está cargado eléctricamente, y además será positivo o negativo.
Los iones a menudo se forman en la naturaleza cuando la electricidad estática extrae electrones de los átomos.
Por ejemplo, cuando ocurre una descarga eléctrica después de tocar la manilla de una puerta, se libera una corriente de electrones, creando así iones.
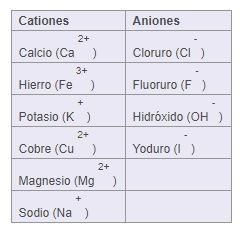
Cationes y Aniones
Un átomo (o grupo de átomos) que ha perdido uno o más electrones se llama ion positivo, también llamado catión.
Un átomo (o grupo de átomos) que ha ganado uno o más electrones se llama ion negativo, también llamado anión.
Un ion con más protones que electrones lleva una carga positiva neta y se llama catión.
Un ion con más electrones que protones lleva una carga negativa neta y se llama anión.
Los cationes se cargan positivamente, sus fórmulas se expresa estableciendo el número de cargas positivas o el número de electrones perdidos con el símbolo +.
De la siguiente manera: X (número de electrones perdidos) +
OJO si no hay número se entiende que es el número 1.
Ejemplos:
El átomo de sodio, Na, al perder 1 electrón, nos da el ion (catión) Na +
El átomo de hierro, Fe, al perder 2 electrones, nos da el ion (catión) Fe 2+
Los aniones, al ganar uno o más electrones se cargan negativamente, y su fórmula se expresa con el número de cargas negativas y el símbolo –.
Se observa de la siguiente manera: X (número de electrones ganados) –
Ejemplos:
El átomo de cloro, Cl, al obtener un electrón, nos da el ion (anión) Cl – .
El átomo de azufre, S, al ganar 2 electrones, nos da el ion (anión) S 2- .
Nota: Los iones pueden ser monoatómicos o poliatómicos:
Un ion monoatómico se forma a partir de un solo átomo.
Ejemplo: ion sodio Na +
Un ion poliatómico se forma a partir de una asociación de varios átomos o también llamada molécula.
Ejemplo: el ion sulfato: SO 4 2-
Todos los átomos y moléculas pueden ser ionizados, incluso hasta el punto de formar un ion de un átomo al que le faltan todos los electrones y tener un átomo totalmente ionizado.
En las moléculas, los átomos se mantienen unidos por los electrones y, dependiendo del tamaño de la molécula, solo se pueden perder unos pocos electrones antes de que la repulsión eléctrica haga que la molécula se rompa.
Los iones negativos están formados por un enlace adicional de electrones al átomo o molécula.
No todos los átomos pueden formar iones negativos, por ejemplo, los iones negativos no existen para los átomos de los gases nobles.
Propiedades de los Iones
Además de tener carga positiva o negativa, los iones pueden unirse rápidamente con iones de carga opuesta.
Algunos compuestos comunes consisten casi por completo en iones unidos químicamente.
Por ejemplo, la sal se compone de una serie repetida de aniones de cloruro y cationes de sodio.
Las propiedades de los compuestos iónicos se relacionan con la fuerza con la que los iones positivos y negativos se atraen entre sí en un enlace iónico.
Otros ejemplos de iones importantes incluyen electrolitos, como los iones cloruro, potasio, magnesio y calcio que son importantes para la salud.
Los electrolitos en las bebidas deportivas ayudan a hidratar el cuerpo.
Los iones de potasio ayudan a regular las funciones cardíacas y musculares.
El calcio es importante para el crecimiento y la reparación ósea, y también juega un papel en el apoyo de los impulsos nerviosos y el suministro de sangre.
Muchas sales están formadas por iones que se liberan cuando la sal se disuelve.
Esto se aplica, entre otras cosas, al cloruro de sodio (sal de cocina), que cuando se disuelve en agua se disocia completamente en iones de sodio e iones de cloruro.
El sabor salado del agua se debe a la presencia de iones de sodio denominados Na +.
Cuanto mayor es la cantidad de material de iones de sodio, más salada es el agua.
Historia y Significado del Ion
El término «ion» fue introducido por el químico y físico inglés Michael Faraday en 1834 para describir las especies químicas que van de un electrodo a otro en solución acuosa.
La palabra ion proviene de la palabra griega ion o ienai , que significa «ir o migrar».
El término ión se debe a que los iones se mueven («migran») en un campo eléctrico.
Si se envía una corriente eléctrica a través de una sustancia disociada, los iones positivos migrarán hacia el electrodo negativo, el cátodo, y por lo tanto se denominan cationes, mientras que los iones negativos se dirigirán hacia el electrodo positivo, el ánodo, y se denominan aniones.
Este proceso se llama electrólisis.
Faraday llamó a los iones positivos para los cationes porque se descargaron en el cátodo y a los iones negativos para los aniones porque se descargaron en el ánodo.
Él creía que los iones fueron creados por los electrodos.
Svante August Arrhenius afirmó 50 años después que los iones surgieron de la descomposición de sales cuando las sales se disolvieron en agua.
Esto se conoce como su teoría de disociación .
William Lawrence Bragg, en 1914, cuando determinó la estructura cristalina de algunas sales simples, demostró que las sales consistían en iones, no en moléculas.
La sal ordinaria, el cloruro de sodio NaCl, no consistía en moléculas de NaCl, sino en iones de sodio Na + e iones de cloro Cl -.
Cada ion de sodio estaba rodeado por seis iones de cloro, y cada ion de cloro estaba rodeado por seis iones de sodio.
Esto tardó mucho tiempo hasta que los químicos lo aceptaran.
Solo cuando se formuló la teoría atómica moderna en la década de 1920 se entendió la realidad del comportamiento de los iones.
Isótopos: Los isótopos son átomos con el mismo número de protones, pero con diferentes números de neutrones en el núcleo.
Los isotopos de un elemento tienen las mismas propiedades químicas.
En contraste, las propiedades físicas pueden variar, y algunos isótopos son inestables / radiactivos.
También te puede interesar conocer: El Plasma el 4º Estado de la Materia
¿Te ha gustado la web Iones?. Pulsa en Compartir y Gracias por Compartir.
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.
Espectacular, mas claro imposible. Muchas gracias