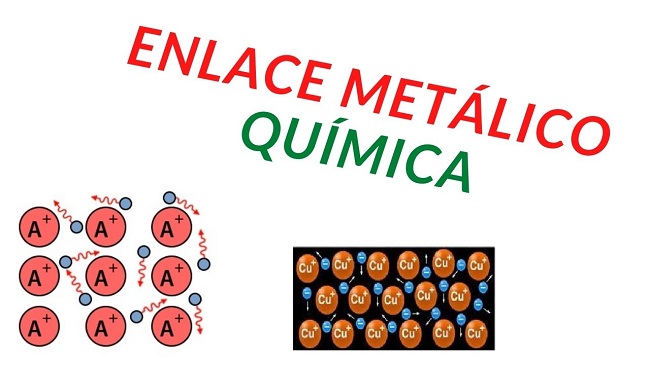
Como sugiere el nombre, este enlace metálico se produce entre los átomos de un mismo metal y permite la cohesión (unión) de los átomos del metal.
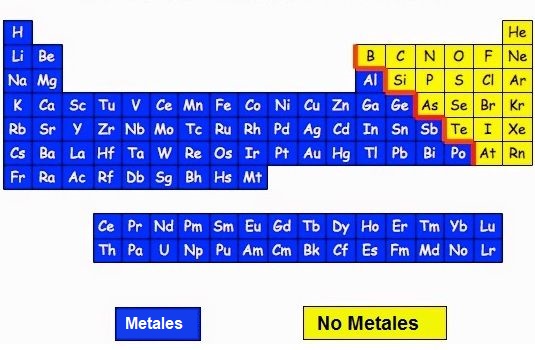
Fíjate en la tabla periódica los elementos de abajo, los metales son los elementos situados a la izquierda en color azul.
Esos son los que forman los enlaces metálicos.
Indice de Contenidos
¿Cómo Se Forman los Enlaces Metálicos?
La mayoría de los metales de los grupos principales tienen solo unos pocos electrones girando en su última capa.
Estos electrones son muy fáciles de desprenderlos del átomo metálico, ya que los núcleos atómicos ejercen solo ligeras fuerzas de atracción sobre los electrones tan alejados del núcleo.
Recuerda = Electrones de la última capa = electrones de valencia = los únicos electrones que se comparten en los enlaces
La mayoría de los metales de los grupos principales tienen solo 1, 2 o 3 electrones de valencia, por lo que tienden a perderlos al formar enlaces.
Por ejemplo, los de la columna 1, como el Na (sodio) tienen 1 electrón de valencia, los de la 2 tienen 2 electrones de valencia, pero el Fe puede tener 2 o 3 electrones de valencia.
Para saber el número de electrones de cada elemento hay que comprobar la Familia de la Tabla Periódica a la que pertenece.
Si no sabes cómo averiguar el número de electrones de valencia de un elemento visita: Configuración Electrónica
Loa átomos, en estado normal, tienen carga eléctrica cero, es decir la carga de los electrones (negativa) y de los protones del núcleo (positiva) del átomo se compensan y se anulan.
Los metales al formar enlaces metálicos pierden los electrones de su última capa (de valencia).
Si le quitamos al átomo metálico uno o más electrones de valencia para compartirlo en el enlace metálico se convierte en ion positivo, ya que la igualdad de carga eléctrica se rompe el robarle el o los electrones al átomo del metal.
Los átomos iniciales, cuando forman el enlace metálico quedarán todos con carga positiva convirtiéndose en iones positivos o cationes porque pierden los electrones de su ultima capa.
En el enlace, además de los iones positivo, tendremos los electrones compartidos.
Estos electrones compartidos en el enlace se mueven por todo el enlace libremente y continuamente, por lo que no se les puede asociar a ninguno de los núcleos de los átomos que forman el enlace.
Estos electrones que se mueven casi libremente, también se les conoce como «gas de electrones» o nube de electrones porque pueden moverse libremente como las partículas de gas.
Esto solo sucede en los enlaces metálicos, no pasa lo mismo en los enlaces iónicos ni en los covalentes.
Finalmente cuando se produce el enlace metálico, el enlace quedaría formado por una red de iones positivos, lo antiguos átomos metálicos que perdieron los electrones de valencia, y por una nube de gas de electrones libres.
Rede de Iones Positivos = red iónica = Los cationes o iones positivos se quedan mas o menos ordenados y los electrones moviéndose libremente por la red iónica.
La nube de electrones actúa como «pegamento» entre los cationes o iones positivos, y por esta razón casi todos los metales son sólidos a temperatura ambiente.
Si no lo tienes claro todavía puedes ver el video de más abajo que te lo explicamos.
Estos electrones que se mueven libremente también permiten que los enlace metálicos tengan una buena conductividad eléctrica y una alta conductividad térmica.
A veces, el gas de electrones también se llama Fermigas en honor al físico italiano ENRICO FERMI (1901-1954).
Video Explicación Enlace Metálico
Te lo explicamos en video por si acaso todavía te quedan dudas o no lo entendiste.
Enlace Metálico y Propiedades Físicas de los Metales
Algunas propiedades físicas de los metales pueden explicarse por el carácter específico del enlace metálico.
– Son buenos conductores del calor y la electricidad debido a que los electrones están libres en la estructura, pudiendo moverse fácilmente cuando se les somete a una corriente eléctrica o calor.
– Son dúctiles y maleables ya que, localmente, los enlaces pueden romperse y volverse a formar ya que la nube de electrones acompaña a los núcleos en su movimiento.
Dúctil = Facilidad para convertir el material en hilos.
Maleable = Facilidad para convertir el material en chapos o láminas
– El brillo metálico se explica debido a que los fotones se reflejan en la nube electrónica y, los que penetran, son absorbidos por lo que se muestran opacos.
– Bajo calor específico que se explica por la facilidad de los electrones para moverse a lo largo del sólido.
La fuerte atracción entre los átomos en los enlaces metálicos hace que los metales sean fuertes y les da alta densidad, alto punto de fusión, alto punto de ebullición y baja volatilidad.
Hay excepciones, por ejemplo, el mercurio es un líquido en condiciones normales y tiene una alta presión de vapor.
De hecho, todos los metales del grupo del zinc (Zn, Cd y Hg) son relativamente volátiles.
Ejemplos de Enlaces Metálicos
Por ejemplo, el grafeno (un alótropo del carbono) exhibe un enlace metálico bidimensional.
Cualquier elemento metálico puro es un ejemplo de enlace metálico: Plata (Ag), oro (Au), cadmio (Cd), hierro (Fe), níquel (Ni), zinc (Zn), cobre (Cu), platino (Pt), aluminio (Al), galio (Ga), titanio (Ti), etc.
Historia Enlaces Metálicos
La naturaleza de los metales ha fascinado a la humanidad durante siglos, porque estos materiales han proporcionado herramientas con propiedades incomparables en la guerra y en la paz.
La razón de sus propiedades y la naturaleza del vínculo que les une ha sido un misterio durante siglos, aunque se ha avanzado enormemente en su procesamiento y elaboración.
A medida que la química se convirtió en una ciencia, quedó claro que los metales constituían la gran mayoría de la tabla periódica de elementos y se logró un tremendo progreso en la descripción de las sales que pueden formarse mediante reacciones con ácidos.
Con el descubrimiento de la electroquímica, quedó claro que los metales están presentes con mayor frecuencia en soluciones como iones cargados positivamente y las reacciones de oxidación de los metales, que se conocen bien en el campo de la electroquímica.
Los metales se visualizarían como iones positivos unidos por un océano de electrones negativos (nube de electrones).
Con el descubrimiento de la mecánica cuántica, este modelo recibió una interpretación más formal en la forma del modelo de electrones libres y su futura expansión, el modelo de electrones cuasi-libres.
En estos dos modelos, los electrones se reconocen como un gas que viaja a través del marco del sólido con una energía que es principalmente isótropa en el sentido de que depende del cuadrado de la amplitud y no de la dirección del vector de onda k.
En el espacio k tridimensional, la totalidad de los puntos de mayor potencial (la superficie de Fermi) debería ser, por tanto, una esfera.
Si te ha gustado enlace metálico pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.