Una pregunta que solemos hacernos en química es:
¿Cuántos átomos o moléculas hay en una cantidad determinada de una sustancia?
Aquí es donde entra en juego el famoso concepto de “Número de Avogadro”.
El Número de Avogadro es nada más y nada menos que 600 mil trillones de moléculas o átomos de una sustancia, es decir, expresado en número es la friolera de:
600.0003000.0002000.0001000.000 = 6,022 x 10 elevado a 23 moléculas o átomos.

La constante de Avogadro se denota por N A
Indice de Contenidos
¿Qué Representa el Número de Avogadro?
Este número está íntimamente ligado a los moles de una sustancia, ya que:
«Un mol de cualquier sustancia contiene el número de Avogadro de átomos o de moléculas»
Un ejemplo, 12 gramos de carbono es un mol de Carbono.
Pues resulta que el número de átomos de carbono contenidos en 12 gramos de carbono 12 es el número de Avogadro 6.022 x 10 elevado a 23 .
Resumiendo: Es el número de partículas existentes en una unidad conocida como mol.
Partículas: átomos o moléculas.
Es importante saber cómo calculamos el número de moles de la sustancia.
Recuerda:
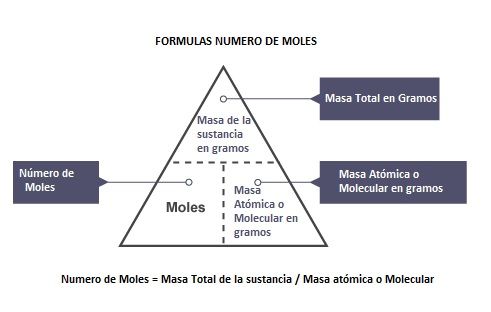
Si hemos usado la masa atómica para el mol serán número de átomos.
Si hemos usado la masa molecular pare el mol serán número de moléculas.
Además si la sustancia está formada toda ella por átomos resulta que el mol nos revelará el número de átomos, pero si la sustancia está formada por moléculas, por ejemplo el agua cuya molécula superconocida es H2O, el mol nos dirá cuantas moléculas de esa sustancia tenemos.
Como la masa de un mol de una sustancia es igual al peso molecular de esa sustancia y el peso molecular medio del agua es 18.015 unidades de masa atómica (uma), tenemos que un mol de agua pesa 18.015 gramos.
Puedes saber más sobre el mol en el siguiente enlace: Mol
Los cambios químicos observados en cualquier reacción implican el reordenamiento de miles de millones de átomos.
No es práctico intentar contar o visualizar todos estos átomos, pero los científicos necesitan alguna forma de referirse a la cantidad total.
También necesitan una forma de comparar estos números y relacionarlos con los pesos de las sustancias, que pueden medir y observar.
La solución es el concepto de mol, que es muy importante en química cuantitativa.
Puntos Clave
– El mol permite a los científicos calcular el número de entidades elementales (generalmente átomos o moléculas) en una determinada masa de una sustancia determinada.
– El número de Avogadro es un número absoluto: hay 6.022 × 10 elevado a 23 entidades elementales en 1 mol.
Esto también se puede escribir como 6.022 × 10 23 mol -1
– La masa de un mol de una sustancia es igual al peso molecular de esa sustancia.
Por ejemplo, el peso molecular medio del agua es 18.015 unidades de masa atómica (uma), por lo que un mol de agua pesa 18.015 gramos.
Cálculos Químicos con el Número de Avogadro
El número de Avogadro es fundamental para comprender tanto la composición de las moléculas como sus interacciones y combinaciones.
Por ejemplo, dado que un átomo de oxígeno se combinará con dos átomos de hidrógeno para crear una molécula de agua (H 2 O), un mol de oxígeno (6.022 × 10 23 de átomos de O) se combinará con dos moles de hidrógeno (2 × 6,022 × 10 23 de átomos de H) para hacer un mol de H 2 O.
Otra propiedad del número de Avogadro es que la masa de un mol de una sustancia es igual al peso molecular de esa sustancia.
Por ejemplo, el peso molecular medio del agua es 18.015 unidades de masa atómica (uma), por lo que un mol de agua pesa 18.015 gramos.
Esta propiedad simplifica muchos cálculos químicos.
Si tienes 1,25 gramos de una molécula con un peso molecular de 134,1 g / mol, ¿Cuántos moles de esa molécula tienes?
1,25g × 1 mol 134,1g = 0,0093 moles 1,25g × 1 mol 134,1g = 0,0093 moles.
Historia del número y cantidad de materia de Avogadro
El número de Avogadro fue nombrado en honor al físico y químico italiano Amedeo Avogadro, un abogado que se interesó por las matemáticas y la física, y en 1820 se convirtió en el primer profesor de física en Italia.
Fue en 1811 cuando el químico y físico italiano Amedeo Avogadro planteó, por primera vez, la idea de que «el número de moléculas en los gases es siempre el mismo para un volumen igual, o siempre es proporcional a los volúmenes».
No fue hasta un siglo después, en 1909, que el físico Jean Perrin logró fijar el número de Avogadro.
Un número que llegó a conocerse como «constante de Avogadro» en 1971, cuando el mol se convirtió en la unidad básica de cantidades de materia .