Vamos a estudiar la configuración electrónica o también llamada distribución electrónica.
Más adelante te enseñaremos una regla (regla de la diagonal) muy sencilla para obtener la configuración electrónica de cualquier elemento.
Además, abajo del todo de la página te dejamos una tabla con la configuración electrónica de todos los elementos, donde podrás comprobar si la tuya es correcta o no.
Aquí te vamos a explicar el cómo se hace y el por qué, cómo siempre de forma clara y sencilla.
Indice de Contenidos
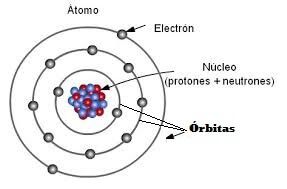
Átomo: Componentes y Órbitas
Recuerda que lo átomos tienen un núcleo donde se encuentran los protones y los neutrones, pero alrededor del núcleo están los electrones girando en las llamadas órbitas.
Un átomo puede tener varias órbitas alrededor de su núcleo y sobre las cuales están girando sus electrones.
¿Qué es la Configuración Electrónica?
La Configuración o Distribución electrónica nos dice como están ordenados los electrones en los distintos niveles de energía (órbitas), o lo que es lo mismo como están distribuidos los electrones alrededor del núcleo de su átomo.
¿Cómo saber los electrones que tienen los átomos en cada una de sus órbita?
Pues bien, eso es lo que se llama la configuración electrónica de un elemento de la tabla periódica.
Poco a poco lo iremos aprendiendo.
¿Para que queremos saber esto?.
Por ejemplo, es muy útil o mejor dicho imprescindible para hacer el enlace covalente y los enlaces iónicos y conocer los llamados electrones de valencia, que son el número de electrones que tiene el átomo de un elemento en su última capa u órbita (subnivel).
Lo primero, cuanto más alejado del núcleo esté girando el electrón mayor es su nivel de energía.
Los electrones, de un átomo, que tengan la misma energía se dice que están en el mismo nivel de energía.
Estos niveles de energía también se llaman orbitales de energía.
Orbitales de Energía
En la actualidad la periferia del núcleo (su alrededor) se divide en 7 niveles de energía diferentes, numerados del 1 al 7, y en los que están distribuidos los electrones, lógicamente en orden según su nivel de energía.
Los electrones con menos energía estarán girando en el nivel 1.
Pero además cada nivel se divide en subniveles.
Estos subniveles en los que se divide cada nivel pueden llegar a ser hasta 4. A estos 4 subniveles se les llama: s, p, d, f.
Resumen: niveles de energía hay del 1 al 7 y subniveles hay 4 el s, p, d y el f.
OJO hay átomos que no tienen los 4 subniveles, como veremos más adelante, y átomos que no tienen los 7 niveles de energía, pueden tener menos.
Esto es precisamente lo que queremos averiguar, cuantos niveles y subniveles de energía tiene un átomo concreto y cuantos electrones tiene en cada uno de estos subniveles y niveles, es decir su Configuración Electrónica.
Además, hay algo muy importante, en cada subnivel solo podemos tener un número máximo de electrones.
Esto hace que podamos saber el número de electrones fácilmente, o lo que es lo mismo la distribución electrónica.
En el subnivel s solo puede haber como máximo 2 electrones, en el p 6, en el d 10 y en el f 14. (en cada nivel hay 4 más que en el nivel anterior, es fácil de recordar).
Veámoslo con una imagen.
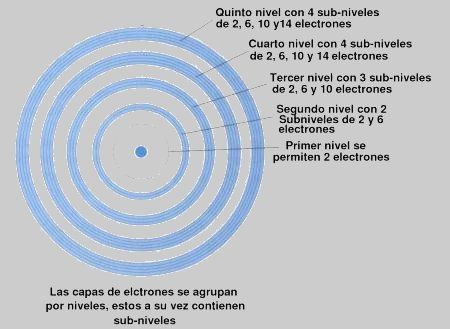
Fíjate en la imagen que en el nivel 1 (no se aprecia el círculo en la imagen pero está ahí) solo se permiten 2 electrones girando en ese nivel y además solo tiene un subnivel, el s. No hay ningún átomo que tenga más de 2 electrones girando en el primer nivel de energía (puede tener 1 o 2 átomos).
Si ahora pasamos al nivel 2, vemos que tiene 2 subniveles, lógicamente el s y el p.
Pero claro en el nivel s solo habrá como máximo 2 electrones y en el p como máximo 6.
Si seguimos viendo la imagen nos daremos cuenta de lo siguiente.
¡¡¡Importante Niveles y Subniveles!!!
Fíjate que fácil: En el nivel 1 hay un subnivel, en el 2, 2 subniveles, en el 3, 3 subniveles y en el 4 hay 4 subniveles. ¿Fácil NO?.
Los últimos niveles un poco diferentes, por ejemplo en el 5, hay 4 subniveles, no puede tener más porque solo existen 4.
Y ahora vamos a contar al revés, en el nivel 6, 3 subniveles y en el último nivel, el 7 solo habrá…
¿Cuantos?
Pues si, habrá 2 subniveles.
Además, si hay un subnivel siempre será el s, si hay 2 serán el s y el p, si hay 3 serán el s, el p y el d, y si hay 4 subniveles serán el s, el p, el d y el f.
Concretemos más nivel a nivel:
– Primero de todo, recordar que en el subnivel s solo puede haber como máximo 2 electrones, en el p 6, en el d 10 y en el f 14.
En cada nivel tendremos:
– En el nivel 1 solo hay un subnivel, y lógicamente será el s.
– El nivel 2 hay 2 subniveles, el s y el p.
– En el nivel 3 hay 3 subniveles el s, el p y el d.
– En el nivel 4 hay 4 subniveles, el s, el p, el d y el f.
Pero OJO el nivel 5 tiene 4 subniveles también, pero en el nivel 6 solo tiene 3 (hasta el d) y en el 7 solo dos subniveles el s y el p.
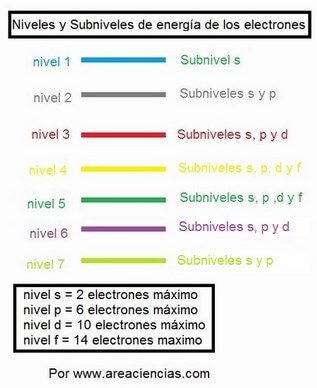
Fíjate como quedarían cada nivel:
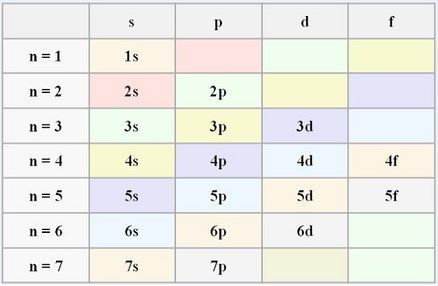
OJO antes de llegar a un nivel superior tendremos que rellenar los niveles más bajo de energía de electrones.
Para llegar al nivel 2p, primero tenemos que llenar de electrones el 1s (con 2 electrones), el 2s (con otros 2) y luego ya llenaríamos el 2p con un máximo de hasta 6, como ya sabemos.
Según esta tabla podríamos saber….
¿Cuántos electrones máximos podemos tener en cada Nivel de Energía?
– En el nivel 1 solo soporta hasta orbitales s (subnivel), por lo tanto, podríamos tener como máximo 2 electrones.
– En el 2, hasta p, por lo tanto, podríamos tener 2 de s y 6 de p, en total 8 electrones.
– En el nivel 3, hasta d, por lo tanto, 2 de s, 6 de p y 10 de d= 18.
– en el 4, hasta f, por lo tanto, 2 de s, 6 de p, 10 de d y 14 de f = 32.
– En el nivel 5, hasta f igual es decir 32.
– En el 6, hasta d (comienzas a perder energía) puede tener como máximo 18 electrones.
– En el nivel 7, hasta p, como máximo 8 electrones.
Como podemos apreciar ningún átomo tendrá una configuración 6f, por ejemplo, pero si 4f en su configuración.
Bien pues ahora si supiéramos cuantos electrones tiene un elemento concreto de la tabla periódica, ya podríamos saber como se distribuyen esos electrones alrededor de su núcleo.
El número de electrones que tiene el átomo de cada una de los elementos diferentes que conocemos viene en la tabla periódica de los elementos, es su número atómico o Z.
No te líes que es muy fácil.
De todas formas veremos como ni siquiera debemos saber esto para hacer la configuración electrónica de un elemento, aunque sería bueno entenderlo.
Veamos algunos ejemplos. Imaginemos el Helio. Sabemos que tiene 2 electrones.
¿Cómo estarán distribuidos?. Sencillo.
El primer nivel permite 2 átomos, pues ahí estarán sus dos electrones.
Además el primer nivel solo permite un subnivel, el s, y en este subnivel puede tener un máximo de 2 electrones.
Conclusión estarán girando alrededor del nivel 1 y sus dos electrones estarán en el subnivel s, del nivel de energía 1.
Cuando queremos hacer la configuración electrónica de un elemento concreto, por ejemplo la de Helio del caso anterior, tendremos que tener una forma de expresarlo y que todo el mundo utilice la misma forma.
Veamos de que forma se hace.
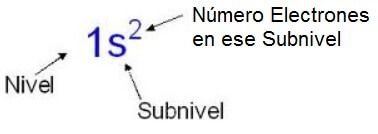
Si te fijas en la imagen, se pone un número que nos dice de qué nivel de energía estamos hablando, detrás y en minúscula, la letra del subnivel de ese nivel del que estamos hablando, y un exponente sobre la letra del subnivel que nos dice el número de electrones que hay en ese subnivel.
En este caso como es el subnivel s nunca podría tener un exponente mayor de 2, ya que son los máximos electrones que puede tener este subnivel.
¡¡¡Ya tenemos la configuración electrónica del Helio!!!.
La más fácil será la del Hidrógeno, que tiene un electrón.
Será 1s1 . ¿Fácil NO?.
¿Y si tiene 3 electrones?
Por ejemplo el caso del Litio (Li).
Tendrá 2 electrones en el primer nivel (son los máximos), y uno en el segundo.
¿Cómo lo expresamos?
1s2 2s1
En el nivel de energía 1 y subnivel s = 2 electrones, ya estaría llena por lo que pasamos al nivel 2.
En este nivel estará el electrón que nos falta por acomodar.
Lo acomodamos en el primer subnivel del nivel 2.
El primer subnivel de un nivel es siempre el s, el segundo el p, el tercero el d y el cuarto el f.
Luego 2s1 significa nivel 2 subnivel s con un electrón.
Ya tenemos los 3 electrones del Litio en su sitio y expresada correctamente su configuración electrónica.
Si tuviéramos más electrones iríamos poniendo el cuarto en el nivel 2 y en el subnivel s (que ya sabemos que entran 2), pero si tuviéramos 5 tendríamos que poner el quinto en el nivel 2 pero en la capa p.
Así sucesivamente.
Pero para esto es mejor utilizar un esquema muy sencillo, ya que algunas veces, antes del llenar algún subnivel posible de un nivel, se llena un subnivel de otro nivel superior.
El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p.
OJO Fíjate que antes de llenarse el nivel 3 por completo, se empieza a llenar el nivel 4 (pasa del 3s, 3p al 4s y no al 3d).
Pero tranquilo para esto hay un esquema muy sencillo.
Regla de la Diagonal
El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal.
Deberás seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta.
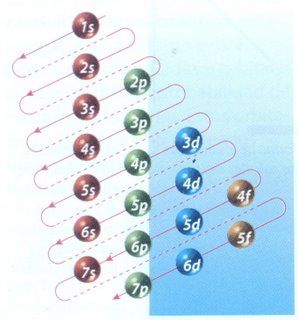
Es importante recordar que los orbitales se van llenando en el orden en que aparecen, siguiendo esas diagonales, empezando siempre por el 1s.
Con esta simple regla, sabiéndose la imagen anterior es muy fácil sacar la configuración electrónica de cualquier elemento.
Veamos como se hace definitivamente.
Configuración Electrónica de los Elementos
Recuerda que en cada subnivel hay un número máximo de electrones s = 2e-, p = 6e-, d = 10e- y f = 14e-
En el subnivel s solo puede haber como máximo 2 electrones, en el p 6, en el d 10 y en el f 14.
Si hacemos la configuración electrónica de un átomo de un elemento con 10 electrones (número atómico que se saca de la tabla periódica, es el Neón) siguiendo la regla de la diagonal su configuración quedaría así:
1s2 2s2 2p6
Explicación
Siguiendo el esquema empezamos por el nivel 1s el cual lo llenamos con su número máximo de electrones (2) y sería 2s2.
Como nos faltan 8 electrones más siguiendo el esquema pasamos al nivel 2s, que también como es nivel s solo puede tener 2 electrones, por lo tanto 2s2.
Ahora pasamos al nivel 2p que por ser nivel p puede tener como máximo 6 electrones, precisamente los que nos faltan para llegar a 10,por lo tanto sería 2p6.
Al final queda:
1s2 2s2 2p6
¿Y si tuviera 9 electrones?
Pues muy sencillo igual pero al llegar al nivel 2p solo pondríamos 5 electrones en ese nivel, 2p5 y quedaría 1s2 2s2 2p5. el nivel 2p no se llena por completo. ¿Fácil no?
Cuantos electrones tiene un átomo en su última capa? Pues en el caso del de 10 electrones en su última capa tendrá 6 electrones y el en el caso del 9, en su última capa tendrá 5.
Estos son sus electrones de valencia.
Por cierto, el de 9 electrones es el Flúor (F) y el de 10 el Neón (Ne).
Lo puedes comprobar en la tabla periódica de los elementos.
Ejemplos de la Configuración Electrónica
Veamos algunos ejemplos más:
Configuración electrónica del Nitrógeno: Lo primero miramos en la tabla periódica y tiene un número atómico = 7.
Con esto sacamos su configuración:
Nitrógeno: 1s2 2s2 2p3
Aquí tienes más ejemplos.
Te ponemos el Z o número atómico primero (en negrita) y luego la configuración electrónica.
Hidrógeno 1 = 1s1
Helio 2 = 1s2
Litio 3 = 1s2 2s1
Berilio 4 = 1s2 2s2
Boro 5 = 1s2 2s2 2p1
Carbono 6 = 1s2 2s2 2p2
Nitrógeno 7 = 1s2 2s2 2p3
Oxígeno 8 = 1s2 2s2 2p4
Flúor 9 = 1s2 2s2 2p5
Neón 10 = 1s2 2s2 2p6
Sodio 11 = 1s2 2s2 2p6 3s1
Magnesio 12 = 1s2 2s2 2p6 3s2
Aluminio 13 = 1s2 2s2 2p6 3s2 3p1
Silicio 14 = 1s2 2s2 2p6 3s2 3p2
Fósforo 15 = 1s2 2s2 2p6 3s2 3p3
Azufre 16 = 1s2 2s2 2p6 3s2 3p4
Cloro 17 = 1s2 2s2 2p6 3s2 3p5
Argón 18 = 1s2 2s2 2p6 3s2 3p6
Potasio 19 = 1s2 2s2 2p6 3s2 3p6 4s1
Calcio 20 = 1s2 2s2 2p6 3s2 3p6 4s2
Ahora es buen momento para que repases con unos ejercicios online en el siguiente enlace: Configuración Electrónica Ejercicios.
¿Quieres saberlos Todos?
Pues aquí tienes.
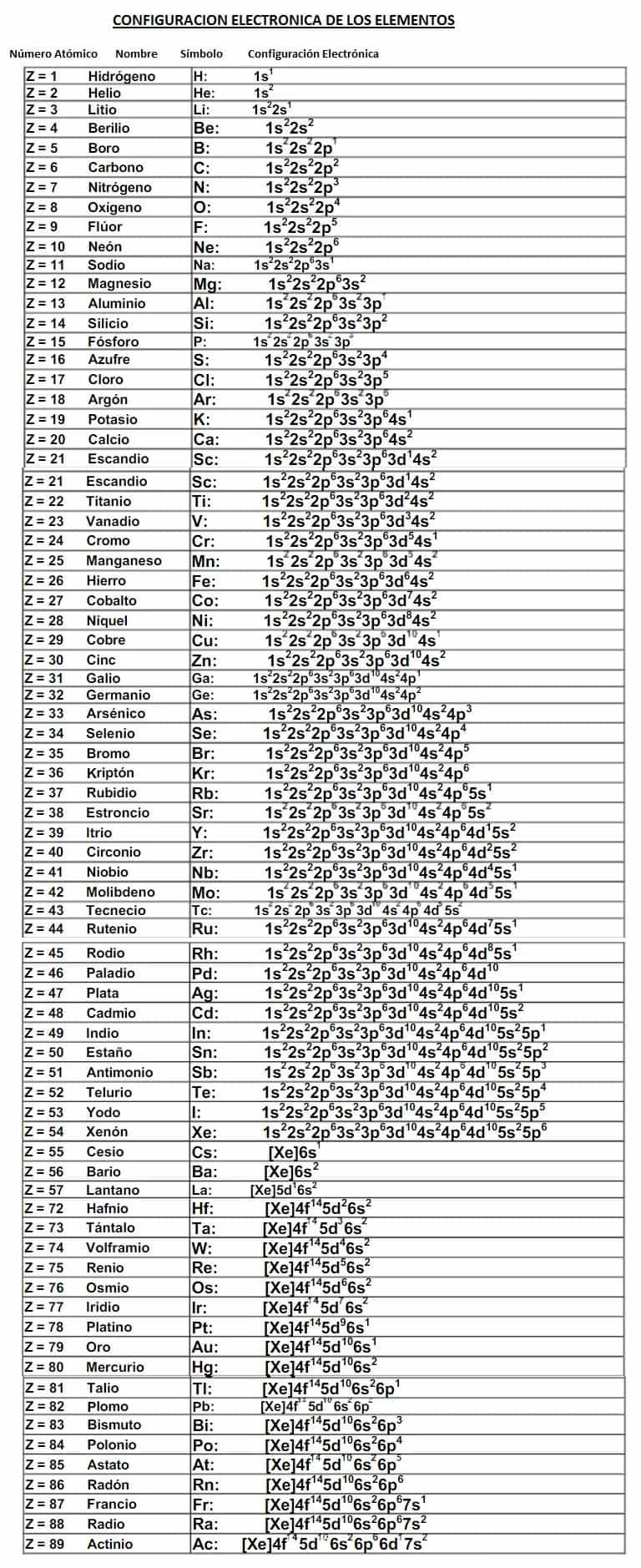
Tabla de la Configuración Electrónica de Todos los Elementos
Vídeo Configuración Electrónica
Si no te ha quedado claro aquí tienes este vídeo que lo explica muy bien:
Si te ha gustado pulsa Configuración Electrónica en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.
Mil gracias por esta excelenge explicación, mejor imposible. Me ha servido de mucho.
muy buen trabajo me ayudaria en este trabajo hidrogeno numero de nivel
¿que significa C.E.E? por que tengo una tarea que dice esto; Escribir la configuración electrónica de los siguientes elementos y luego indicar su C.E.E
CEE significa configuración electrónica del Elemento. Vamos que escribas la configuración electrónica de cada elemento de la tarea. Un saludo
Hola! Significa configuración electrónica externa
significa configuracion electronica externa
No se si estoy equivocada pero en la configuración del yodo está mal porque no se siguió de forma Diagonal sino lineal
La Configuración electrónica esta muy fácil de aplicar pero hay otros ejemplos mas complicados que no he encontrado por ningún lado y nadie los explica.
Lo fácil es equilibrar el peso atómico con el numero de electrones, es decir, el peso atómico es 2, entonces hay 2 (+) y hay dos electrones (2-).
Pero que pasa si el peso atómico es 2, es decir, hay 2(+), pero tiene cargas positivas???
Por ejemplo, el Helio (H+²) cual sería su configuración electrónica??
cual es el elemento de X=〖1s〗^2,〖2s〗^2,〖3p〗^6,〖3s〗^2,〖3p〗^6,〖4s〗^2
Hola me ayudan? Escriba y dibuje la configuración electrónica de las siguientes especies: a) Na+, b) Fe3+,
c) Cr2+ y d) Br por favor 🙁
No resolvemos problemas. Un saludo
Mejor explicación no hay… mil gracias 😊😊😊👍👍👍
Me gusta el fri faier
que significa Xe para configurar el número atómico 81
Excelente página, muy útil, como docente de química, me ha servido bastante
Excelente explicación, estaba revisando diferentes fuentes para explicar a mi hija, pues no recordaba el tema. De lejos, este es el sitio que mejor lo expone.
Gracias!
Excelente explicación. Muchas gracias!
excelente explicación me ayudó como no tiene idea muchísimas gracias
excelente guía de estudio
excelente documento para estudiarlo