La electronegatividad es una medida de la tendencia de un átomo a atraer electrones de átomos vecinos dentro de una molécula.
Es muy importante en química ya que determina el tipo de enlace que forman 2 elementos químicos, como luego veremos.
La electronegatividad de un elemento dentro de un enlace químico se refiere a la fuerza de atracción que este elemento ejerce sobre los electrones que forman parte del enlace.
Por eso primero veamos como averiguar la electronegatividad de un elemento para luego aplicarlo para averiguar el tipo de enlace que forma con otro diferente.
Indice de Contenidos
Calcular Electronegatividad
El químico estadounidense Linus Pauling estableció la primera escala de electronegatividad y para ello asignó arbitrariamente el valor 4.0 al átomo con la mayor electronegatividad, el flúor.
La tabla de mas abajo muestra la variación en la electronegatividad de los átomos que aumenta de izquierda a derecha en períodos y de abajo hacia arriba en las familias de la tabla periódica.
El átomo más electronegativo es, por tanto, el átomo de F con 4.0 y los átomos menos electronegativos son los átomos de cesio y francio con 0.7.
Tabla de Electronegatividad
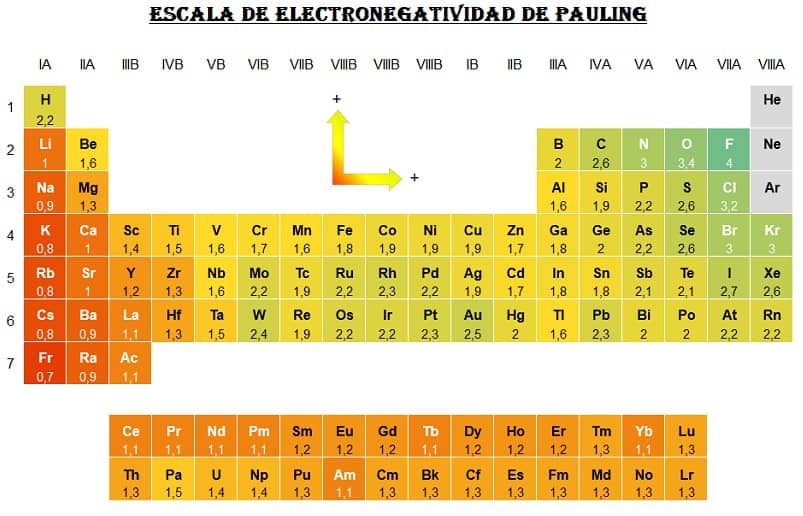
Atención: Los valores pueden diferir en cada tabla periódica, dependiendo del método de medición utilizado.
la de arriba es la Pauling.
Tipos de Enlaces Según Electronegatividad
Vamos a empezar por una regla sencilla y luego veremos que se puede ampliar un poco más.
Si la diferencia de electronegatividades delos elementos que forman el enlace es superior a 1,7, siempre hay un enlace iónico.
Si la diferencia es un valor por debajo de 1,7 siempre hay un enlace atómico.
Diferencia Electronegatividad > 1.7 = enlace iónico
Diferencia Electronegatividad <1,7 = enlace covalente
Expliquemos esto un poco más.
Dos átomos que tienen una fuerte diferencia en electronegatividad forman un enlace iónico.
Covalente iónico ==> diferencia de electronegatividades superior o igual a 1.7
Ejemplo: NaCl → Na:0,9, Cl: 3,2 diferencia de electronegatividades: 3,2 – 0,9 = 2,3 por lo tanto enlace iónico.
Dos átomos con electronegatividad cercana o igual forman un enlace covalente.
Covalentes hay de 2 Tipo: Polar y No Polar.
Los electrones de una molécula pertenecen más a un átomo que al otro que está unido a él, en este caso, el enlace se denomina enlace covalente polar.
Covalente polar ==> diferencia de electronegatividades de entre 1.7 y 0.4
H2O → O: 3,4, H: 2,2 diferencia de electronegatividades: 3,4 2,2 = 1,2 por lo tanto covalente polar.
Los electrones de enlace en una molécula pertenecen por igual a un átomo como al otro que está unido a él: en este caso, se dice que el enlace es un enlace covalente perfecto o no polar.
Covalente NO polar ==> diferencia de electronegatividades igual o inferior 0.4
El oxígeno siempre viene en un paquete doble (02).
Si hacemos la diferencia sería 3,4-3,4 = 0
Esto significa que una partícula de oxígeno tira de los electrones con la misma fuerza que la otra.
En este caso, se habla de un enlace no polar, ya que es más probable que ninguno de los socios de unión atraiga los electrones negativos.
Otro ejemplo sería:
CH4 → C: 2,6, H: 2,2 diferencia de electronegatividades: 2,6 -2,4 = 0,4 por lo tanto covalente No Polar.
¿Qué enlace Es Más Fuerte?
También podemos averiguar si un enlace químico es más fuerte que otro gracias a la electronegatividad.
Por ejemplo, se puede ver en la electronegatividad que una molécula de fluoruro de hidrógeno (HF) forma un dipolo más fuerte que una molécula de cloruro de hidrógeno (H-Cl), ya que el flúor tiene una electronegatividad más alta que el cloro y, por lo tanto, atrae el par de electrones de enlace del hidrógeno con más fuerza que el cloro.
Ejemplos Tipo de Enlaces Por Electronegatividad
NaCl => Na = 0,9; Cl = 3,2 la diferencia será 3.2-0.9= 2.3 por lo que será iónico.
A partir de ahora te ponemos las 2 electronegatividades, las de los 2 elementos que intervienen en el enlace, la resta y el tipo de enlace.
Recuerda que las electronegatividades las puedes ver en la tabla anterior.
HCl => 2,2 y 3,2 => 3.2-2.2 = 1 Enlace Covalente Polar
H2 => 2,2 y 2,2 => 2,2 – 2,2 = 0 Enlace Covalente NO Polar (también se puede llamar equitativo)
SrCl2 = 1.3, 3.0 (3.0-1.3) = 1.7 de Carácter iónico.
NH3 = 3.0, 2.1 (3.0-2.1) = 0.9 Covalente Polar.
PCl3 = 2.1, 3.0 (3.0-2.1) = 0.9 Covalente Polar
LiCl = 1.0, 3.0 (3.0- 1.0) = 2.0 Iónico
Etano: C₂H₆ => 2,6 y 2,2 Diferencia 2,6-2,2 = 0,4 Covalente No Polar
El Propano: C₃H₈ y el Butano: C₄H₁₀ también serán No Polar.
¿Te ha gustado la página sobre la Electronegatividad? Pulsa en Compartir. Gracias
© Se permite la total o parcial reproducción del contenido, siempre y cuando se reconozca y se enlace a este artículo como la fuente de información utilizada.
¿la electronegatividad puede tener valores negativos ósea por debajo de cero? por ejemplo : -1,4